
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数。
[方案一]
称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中,需加热至恒重的目的是
。
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是
。
[方案三]
按如下图所示装置进行实验: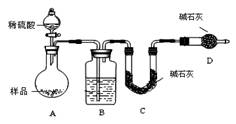
(1)D装置的作用是 。
分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重 8.80g,则样品中NaHCO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
。
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
________________________________________________________________________。
(2)实验中需加热至恒重的目的是:
________________________________________________________________________。
(3)实验中确定加热至恒重的方法是:
________________________________________________________________________。
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”、“偏小”或“不变”)。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-===BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为______________。
(2)实验中判断沉淀是否完全的方法是
________________________________________________________________________________________________________________________________________。
(3)实验中洗涤沉淀的操作是
________________________________________________________________________。
(4)实验中判断沉淀是否洗涤干净的方法是
_______________________________________________________________________________________________________________________________________________。
[方案三]
按如图所示装置进行实验:
(1)B装置内所盛试剂是________;D装置的作用是______________;分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:____________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《化学实验基础》专题综合测试(苏教版) 题型:实验题
(11分)化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
________________________________________________________________________。
(2)实验中需加热至恒重的目的是:
________________________________________________________________________。
(3)实验中确定加热至恒重的方法是:
________________________________________________________________________。
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”、“偏小”或“不变”)。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-===BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为______________。
(2)实验中判断沉淀是否完全的方法是
________________________________________________________________________________________________________________________________________。
(3)实验中洗涤沉淀的操作是
________________________________________________________________________。
(4)实验中判断沉淀是否洗涤干净的方法是
_______________________________________________________________________________________________________________________________________________。
[方案三]
按如图所示装置进行实验:
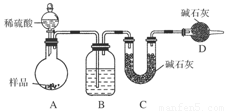
(1)B装置内所盛试剂是________;D装置的作用是______________;分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com