
【题目】一种“既热即食型”快餐适合外出旅行时使用,它是利用两种物质发生化学反应对食物进行加热,这两种化学物质最适合选择的是( )
A. 浓硫酸与水B. 氢氧化钠与水C. 生石灰与水D. 氯化钠与水
科目:高中化学 来源: 题型:
【题目】在同温同压下,a g气体A与b g气体B的分子数相同,下列说法中不正确的是( )
A. A与B两种气体的相对分子质量之比为a∶b
B. 在同温同压的条件下,A与B两种气体的密度之比为b∶a
C. 同质量的A、B两种气体的分子个数之比为b∶a
D. 相同条件下,同体积A气体与B气体的质量之比为a∶b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③标准状况下,22.4 L H2O中分子数为NA
④32 g O2和O3混合气体中含有原子数为2NA
A.①②③④B.①②④C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在保证安全的前提下,学以致用是我们化学学习中一直倡导的理念。某同学欲用NaOH固体配制480 mL质量分数为25%,密度为1.2 g·cm-3的溶液,下列说法不正确的是( )
A. 需用托盘天平称量NaOH固体的质量为144 g
B. 容量瓶用蒸馏水洗净后,不必烘干就能用于配制溶液
C. 定容时俯视容量瓶的刻度线,会造成所配制溶液物质的量浓度偏高
D. 该溶液的物质的量浓度约为7.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 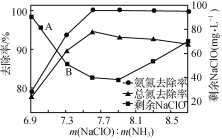 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1 在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2 向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3 在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4 将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5 将晶体在图3所示热水浴上加热干燥。
(1)图1中仪器A的作用是____________。
(2)步骤2中Na2CO3需分批加入的原因是_________________________________________________。
(3)水蒸气蒸馏时,判断蒸馏结束的方法是________。
(4)步骤4中,“趁热过滤”的目的是_____________。
(5)抽滤时所需主要仪器有____、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入用待测液润洗过的锥形瓶中,并加入3滴甲基橙溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)

(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_______________。
(4)判断到达滴定终点的现象是:锥形瓶中溶液_________________________。
(5)下列操作会引起实验结果偏大的是:______(填编号)
A.滴定终点时,有一滴标准液悬挂在滴定管尖嘴处
B.观察计数时,滴定前俯视,滴定后仰视
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.配制标准NaOH溶液定容时仰视观察刻度线
Ⅱ.(6)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式:________________________________________。KMnO4应装在___________滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂?___(填“是”或“否”),滴定终点的判断方法:_____________________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入______________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. 电池放电过程的正极反应式:O2+2H2O+4e-=4OH-
D. 多孔电极可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com