
����Ŀ����1����Mg��Al��Ϸ�ĩ10.2 g����50 mL 4 mo1��L��1�����ᣬ������2mo1��L��1������������Һ��ʹ�ó����ﵽ���������������������Ƶ����Ϊ_____mL��
��2����״���£���������ZnͶ�뵽һ������Ũ�����У���ȫ��Ӧ���ռ���336 mL���壬��������ͨ��������ˮ�У�Ȼ���������BaCl2��Һ�����ʵ�������ø������2.33 g���ɴ���֪��������SO2���������Ϊ________��
��3��ij��ѧѧϰС���ڽ���֪ʶ����ʱ�������¹��ɣ���Щ��Ӧ������Һ��Ũ��ϡ�����ܵ��������������ʱ��������ݴ��ⶨ�����¼��������Ŀ�����������Ӧ�𰸡�
I��ʵ������ȡ�����Ļ�ѧ����ʽΪMnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2����MnO2��������ϡ���ᣩ�����������ַ�����ȡ���������ú�HCl 146 g��Ũ������������MnO2��Ӧ������87 g MnO2��������Ũ���ᷴӦ��������HCl�Ļӷ��������ַ������ɵ����������Ƿ�����____���������������������������������ڡ�
MnCl2��2H2O��Cl2����MnO2��������ϡ���ᣩ�����������ַ�����ȡ���������ú�HCl 146 g��Ũ������������MnO2��Ӧ������87 g MnO2��������Ũ���ᷴӦ��������HCl�Ļӷ��������ַ������ɵ����������Ƿ�����____���������������������������������ڡ�
II����100 mL��18 mo1��L��1��Ũ������������ͭ��ַ�Ӧ����Һ����������ӵ����ʵ���____����������������������������0.9 mol��
���𰸡�100 66.7% �� ��
��������
(1)����2mol/L������������Һ��Ҫʹ�����ij�����������������Ϊ������þ��������������ʱ��ҺΪ�Ȼ�����Һ���������������������غ�����������Ƶ����ʵ����������������������
(2)����BaSO4���������������ʵ������ٽ��ԭ���غ��SO2��������ʵ�������������������SO2�����������
(3)I������MnO2��ŨHCl��Ӧ�����ŷ�Ӧ�Ľ��У�ŨHCl��ϡ��ϡ�������MnO2��Ӧ��MnO2����ʱ������ȷ���������������Ũ��������ʱ���ܸ���MnO2���������������������
II��ͭ��Ũ���ᷴӦ���ŷ�Ӧ�Ľ��У�Ũ�����ϡ��ͭ��ϡ�����Ӧ��
(1)Ҫʹ�����ij�����������������Ϊ������þ��������������ʱ��ҺΪ�Ȼ�����Һ���������������������غ��֪��n(NaOH)=n(NaCl)=n(HCl)=0.05L��4mol/L=0.2mol������������������Һ�����Ϊ![]() =0.1L=100mL��
=0.1L=100mL��
(2)2.33 gBaSO4�����ʵ���Ϊ![]() =0.01mol����ԭ���غ�֪���������SO2�����ʵ���Ϊ0.01mol����״���µ����Ϊ0.01mol��22.4L/mol=0.224L=224mL�����������SO2���������Ϊ
=0.01mol����ԭ���غ�֪���������SO2�����ʵ���Ϊ0.01mol����״���µ����Ϊ0.01mol��22.4L/mol=0.224L=224mL�����������SO2���������Ϊ![]() =66.7%��
=66.7%��
(3)I��146 g HCl�����ʵ���Ϊ![]() =4mol��87 g MnO2�����ʵ���Ϊ
=4mol��87 g MnO2�����ʵ���Ϊ![]() =1mol������MnO2��ŨHCl��Ӧ�����ŷ�Ӧ�Ľ��У�ŨHCl��ϡ��ϡ�������MnO2��Ӧ��MnO2����ʱ������ȷ������������������MnO2��4HCl(Ũ)
=1mol������MnO2��ŨHCl��Ӧ�����ŷ�Ӧ�Ľ��У�ŨHCl��ϡ��ϡ�������MnO2��Ӧ��MnO2����ʱ������ȷ������������������MnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2����֪��Ӧ���в���������С��1mol����Ũ��������ʱ����Ӧ�ڸ���MnO2�������������������Ϊ1mol�������ַ������ɵ����������Ƿ����٣��ڣ�
MnCl2��2H2O��Cl2����֪��Ӧ���в���������С��1mol����Ũ��������ʱ����Ӧ�ڸ���MnO2�������������������Ϊ1mol�������ַ������ɵ����������Ƿ����٣��ڣ�
II��100 mL��18 mo1��L��1��Ũ������������H2SO4�����ʵ���Ϊ18mol/L��0.1L=1.8mol��ͭ��Ũ���ᷴӦ��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O������ԭ��Ũ����Ϊ�μӷ�Ӧ��Ũ�����һ�룬���ŷ�Ӧ�Ľ��У�Ũ�����ϡ��ͭ��ϡ�����Ӧ���ʲμӷ�Ӧ������С��1.80mol����ԭ����������ʵ���С��0.900mol����ԭ���غ��֪��ַ�Ӧ����Һ����������ӵ����ʵ�����1.8mol-0.9mol=0.9 mol��
CuSO4+SO2��+2H2O������ԭ��Ũ����Ϊ�μӷ�Ӧ��Ũ�����һ�룬���ŷ�Ӧ�Ľ��У�Ũ�����ϡ��ͭ��ϡ�����Ӧ���ʲμӷ�Ӧ������С��1.80mol����ԭ����������ʵ���С��0.900mol����ԭ���غ��֪��ַ�Ӧ����Һ����������ӵ����ʵ�����1.8mol-0.9mol=0.9 mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L�ĺ����ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��

��1���÷�Ӧ�Ļ�ѧ����ʽΪ_____��
��2���ӷ�Ӧ��ʼ��10sʱ����Y��ʾ�ķ�Ӧ����Ϊ________��X��ת����Ϊ_____ ��
��3��10sʱ���÷�Ӧ ___ �ﵽ�˻�ѧƽ��״̬������ǡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��NaOH��Ħ������Ϊ��__________ ��
��2��24.5��H2SO4�����ʵ���Ϊ��___________��
��3������£�8.96LCO2������Ϊ��___________��
��4����3.01��1023��Nԭ�ӵ�NH3�ڱ���µ����Ϊ:_____________ ��
��5��3g����п��������ϡ���ᷴӦ�����ɱ���µ��������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£����淴Ӧ��2NO(g)��O2(g)![]() 2NO2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־���ǣ� ��
2NO2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־���ǣ� ��
�ٵ�λʱ��������nmolO2��ͬʱ����2nmolNO2
�ڵ�λʱ��������nmolO2��ͬʱ����2nmolNO
����NO2��NO��O2��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ѹǿ���ٸı��״̬
��������ƽ����Է����������ٸı��״̬
A. �٢ܢޢ�B. �ڢۢݢ�C. �٢ۢܢ�D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����Һ������������Һ�������ϣ��õ��ij������к���Ԫ�ص���������Һ�к���Ԫ�ص�������ȣ���ԭ�Ȼ�����Һ������������Һ�����ʵ���Ũ��֮�ȿ�����
��1��3����2��3����1��4����2��7���������
A.�٢�B.��C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ���

A. ͼ�ٱ�ʾN2O4(g)![]() 2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ�۱�ʾ10 mL0.01 mol/LKMnO4������Һ�����0.1mol/LH2C2O4��Һ���ʱ��n(Mn2+)��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g)+H2(g)![]() CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol����������1.6mol̼�����ƹ����Ϻ����ܱյ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ��������� �� ��
A. Na2CO3 B. NaOH��Na2CO3 C. Na2O2�� Na2CO3 D. Na2O2�� NaOH ��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���� 5 g �����Ͻ�Ͷ�뵽 200 mL ��ˮ�У�������ȫ�ܽ⣬���� 4.48 L ��״���µ����壬��Һ��ֻ��һ�����ʡ����������ó������Ͻ������ֽ��������ʵ���֮��Ϊ_______��������Һ�����ʵ����ʵ���Ũ��Ϊ__________(������Һ����仯���Բ���)��
���� NaOH��AlCl3��MgCl2 ���ֹ�����ɵĻ������������ˮ�У��� 0.58 g ��ɫ���������������� ����Һ����μ��� 0.5 mol L-1 �����ᣬ�����������������ɳ�������������ͼ��ʾ��
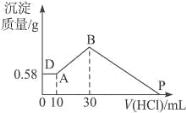
����㣺
��1��������� MgCl2 ������__________g��
��2��P ���ʾ�����������_________ml��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�о����֣���CO2��ѹ�ϳɼ״���Ӧ��CO2+3H2=CH3OH+H2O���У�Co�����︺�ص�Mn�������������Ӵ������и��ԣ���ʾ�����õ�Ӧ��ǰ�����ش��������⣺
��1��Co��̬ԭ�Ӻ�������Ų�ʽΪ_____________��Ԫ��Mn��O�У���һ�����ܽϴ����_________����̬ԭ�Ӻ���δ�ɶԵ������϶����_________________��
��2��CO2��CH3OH������Cԭ�ӵ��ӻ���ʽ�ֱ�Ϊ__________��__________��
��3����CO2��ѹ�ϳɼ״���Ӧ���漰��4�������У��е�Ӹߵ��͵�˳��Ϊ_________��ԭ����______________________________��
��4�����������Ʊ�������Ӧ������ԭ�ϣ�Mn(NO3)2�еĻ�ѧ�����˦Ҽ��⣬������________��
��5��MgO����NaCl�ͽṹ����ͼ�������������Ӳ��������������ܶѻ���ʽ��X��������ʵ����MgO�ľ�������Ϊa=0.420nm����r(O2-)Ϊ________nm��MnOҲ����NaCl�ͽṹ����������Ϊa' =0.448 nm����r(Mn2+)Ϊ________nm��
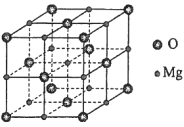
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com