
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
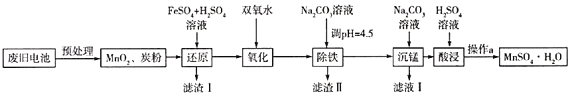
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
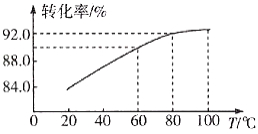
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
【答案】2 4 ×10-21 molL-1 离子键、(极性)共价键 Fe(OH)3 MnO2 +4H++2Fe2+=2Fe3++Mn2++2H2O c 7Na2CO3+7MnSO4+ 11H2O=MnCO36Mn(OH)25H2O↓+7Na2SO4+6CO2↑
【解析】
(3)废旧电池预处理后得到MnO2和炭粉,加入硫酸和硫酸亚铁溶液,二氧化锰具有强氧化性,将亚铁离子氧化成铁离子,得到滤渣I为C,滤液中主要含Fe3+和Mn2+;加入双氧水将过量的亚铁离子氧化,然后加入碳酸钠调节pH值4.5,得到Fe(OH)3沉淀,除去Fe3+,之后再加入碳酸钠溶液进行沉锰得到MnCO36Mn(OH)25H2O,加硫酸溶解得到MnSO4溶液,蒸发浓缩冷却结晶过滤得到硫酸锰晶体。
(1)由题给条件知KMnO4是强酸强碱盐,故HMnO4是强酸,0.01 molL-l的HMnO4溶液的pH=2。
(2)对于反应Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),K=![]() =
=![]() ,当c(Mn2+)=1 ×10-6 molL-1,可求出c(Pb2+)=4 ×10-21 molL-1。
,当c(Mn2+)=1 ×10-6 molL-1,可求出c(Pb2+)=4 ×10-21 molL-1。
(3)①MnSO4是离子化合物,含有离子键,![]() 中含有极性共价键;
中含有极性共价键;
②根据分析可知滤渣Ⅱ主要成分是Fe(OH)3;由流程图知,MnO2被Fe2+还原为Mn2+,Fe2+则被氧化为Fe3+,根据电子守恒和元素守恒可知反应的离子方程式为MnO2 +4H++2Fe2+= 2Fe3+ + Mn2+ +2H2O;由图知当温度达到80 ℃后,MnO2的转化率几乎没有变化,故温度控制在80℃左右为好,再升高温度转化率变化不大,反而浪费资源;
③碳酸根水解显碱性,锰离子水解显酸性,二者相互促进,所以生成的气体应为CO2,故可先写出Na2CO3+MnSO4+ H2O→MnCO36Mn(OH)25H2O↓ +CO2↑,根据质量守恒定律确定有Na2SO4生成,得到7Na2CO3+7MnSO4+11H2O=MnCO36Mn(OH)25H2O↓ +6CO2↑ +7Na2SO4。


科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:

下列说法不正确的是
A.步骤①需要将干海带放入坩埚中灼烧
B.步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O
C.步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D.若步骤③加入的试剂是CCl4,振荡、静置后,液体分层,上层紫色,下层无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯(![]() )是一种有机合成的中间体。下列关于对三联苯的说法中正确的是
)是一种有机合成的中间体。下列关于对三联苯的说法中正确的是
A.对三联苯属于苯的同系物
B.对三联苯分子中至少有16个原子共平面
C.对三联苯的一氯取代物有6种
D.0.2mol对三联苯在足量的氧气中完全燃烧消耗5.1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____。
(2)AsF3 分子的空间构型为_____,As 原子的杂化轨道类型为_____。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____,配原子为_____。
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________,阴离子的平均配位数与纯粹的 NiO 晶体相比____________(填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________示例:Fe3O4 写作 Fe2+Fe23+O4)。

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________并说明 a=__________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图均是由4个碳原子结合成的五种有机物(氢原子没有画出) 回答下列问题:

(1)空间结构为正四面体的化学式为___________________。
(2)五种物质中属于烯烃的是 ________(填字母,下同)。
(3)与e互为同分异构体的是_____________________。
(4)五种物质中4个碳原子一定处于同一平面的有_______________。
(5)写出b的一种同分异构体的结构简式:_____________________(C除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
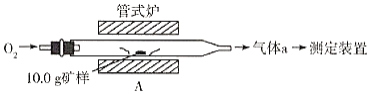
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH(OH)CH2CH3![]() CH3CH=CHCH3+H2O,下列有关说法不正确的是( )
CH3CH=CHCH3+H2O,下列有关说法不正确的是( )
A.CH3CH=CHCH3分子中所有碳原子处于同一平面
B.与CH3CH=CHCH3和Cl2的加成产物分子式相同的物质共有8种(不考虑立体异构)
C.CH3CH(OH)CH2CH3与甘油互为同系物
D.CH3CH(OH)CH2CH3、CH3CH=CHCH3均能使酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.乙烷燃烧热的热化学方程式:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-2319.6 kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的溶解方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法正确的是( )
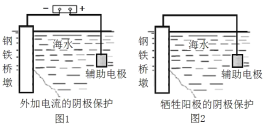
A.图1辅助电极的材料应为铜
B.图1通入的保护电流只与钢铁桥墩和辅助阳极的材料有关
C.图2钢铁桥墩上发生的反应是O2+2H2O+4e-=4OH-
D.钢铁桥墩在河水的腐蚀比海水中更快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com