
【题目】830 K时,在密闭容器中发生下列可逆反应: CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0 。请回答下列问题:
CO2(g)+H2(g) ΔH<0 。请回答下列问题:
(1)若起始时c(CO) =2 mol·L-1,c(H2O) =3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____;用H2O表示的化学反应速率为_____。
(2)在相同温度下,若起始时c(CO) =1 mol·L-1,c(H2O) =2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,此时v(正)______ v(逆) (填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值可能为______。
a.1 b.2 c.0.5
【答案】1 0.3 mol·L-1·s-1 大于 b
【解析】
CO的转化率为60%,则转化了1.2mol/L,
(1) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
始(mol/L) 2 3 0 0
转(mol/L) 1.2 1.2 1.2 1.2
平(mol/L) 0.8 1.8 1.2 1.2
K=![]() =
=![]() =1
=1
v(H2O)=![]() =
=![]() =0.3 mol·L-1·s-1;
=0.3 mol·L-1·s-1;
(2) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
始(mol/L) 1 2 0 0
转(mol/L) 0.5 0.5 0.5 0.5
一段时间(mol/L) 0.5 1.5 0.5 0.5
Qc=![]() =
=![]() =
=![]() <1,平衡正向移动,因此v(正>v(逆);
<1,平衡正向移动,因此v(正>v(逆);
(3)该反应为放热反应,降低温度,平衡常数K增大,有可能是2。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.将pH=a的醋酸稀释为pH=a+1的过程中,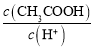 不变
不变
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是

A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)> c(OH—)>c(H+)
D.在D点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知H-O键能为463 kJ·mol-1,O=O键能为498 kJ·mol-1。若1 mol氢气完全燃烧生成1 mol气态水放出241 kJ的热量,计算H-H键能为______kJ·mol-1。
(2)已知化学方程式:H2(g)+![]() O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
O2(g) ==H2O(g),该反应的活化能为167.2 kJ·mol-1,其逆反应的活化能为409.0 kJ·mol-1,写出该反应的逆反应的热化学方程式: ________。
(3)4Al(s)+3O2(g)==2Al2O3(s)ΔH1,4Fe(s)+3O2(g)==2Fe2O3(s)ΔH2,则ΔH1________ΔH2(选填“﹥”、“﹤”或“﹦”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反应式为I2+2![]() =2I+
=2I+![]() 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中物质的循环利用有多种模式。例如:
下列表述正确的是 ( )。
A.图Ⅰ可用于合成氨中N2、H2的循环
B.图Ⅰ可用于氨碱法制纯碱中CO2的循环
C.图Ⅱ可用于电解饱和食盐水中NaCl的循环
D.图Ⅲ可用于氨氧化法制硝酸中NO的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
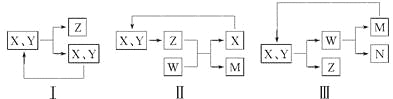
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在_________________部分发生反应,在_____________部分开始生成铁和炉渣。
(2)炼钢时,除磷的化学方程式为________________________________;加入硅、锰和铝的目的是________________________________________。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹_____(填“前”或“后”)加入,原因是______________________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物_______________________________。从环保和经济角度考虑,上述尾气经处理可用作__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰![]() 的化学性质与卤素
的化学性质与卤素![]() 很相似,化学上称之为拟卤素,其氧化性介于
很相似,化学上称之为拟卤素,其氧化性介于![]() 和
和![]() 之间,下列有关反应方程式不正确的是
之间,下列有关反应方程式不正确的是![]()
![]()
A.![]() 和NaOH溶液反应:
和NaOH溶液反应:![]()
B.![]() 和HCN反应:
和HCN反应: ![]() 浓)=
浓)=![]()
C.向KCN溶液中加入碘水:![]()
D.在NaBr和KCN混合溶液中通入少量![]() :
:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com