

 .
. 、
、 .
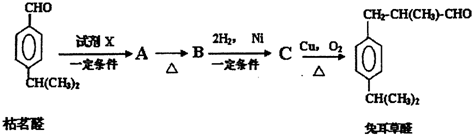
. 分析 C发生氧化反应生成兔耳草醛,根据兔耳草醛结构简式知,C结构简式为 ;根据题给信息知,枯茗醛和X发生加成反应生成A,A发生消去反应生成B,B发生加成反应生成C,从A到兔耳草醛其碳原子个数不变,则X为CH3CH2CHO,A为
;根据题给信息知,枯茗醛和X发生加成反应生成A,A发生消去反应生成B,B发生加成反应生成C,从A到兔耳草醛其碳原子个数不变,则X为CH3CH2CHO,A为 ,A→B发生醇的消去反应,生成B为
,A→B发生醇的消去反应,生成B为 ,B→C发生加成反应,据此答题.
,B→C发生加成反应,据此答题.
解答 解:C发生氧化反应生成兔耳草醛,根据兔耳草醛结构简式知,C结构简式为 ;根据题给信息知,枯茗醛和X发生加成反应生成A,A发生消去反应生成B,B发生加成反应生成C,从A到兔耳草醛其碳原子个数不变,则X为CH3CH2CHO,A为
;根据题给信息知,枯茗醛和X发生加成反应生成A,A发生消去反应生成B,B发生加成反应生成C,从A到兔耳草醛其碳原子个数不变,则X为CH3CH2CHO,A为 ,A→B发生醇的消去反应,生成B为
,A→B发生醇的消去反应,生成B为 ,B→C发生加成反应,
,B→C发生加成反应,
(1)据上述分析,X为CH3CH2CHO,故答案为:CH3CH2CHO;
(2)A→B发生醇的消去反应,B为 ,B中含有官能团的名称有:醛基、碳碳双键,
,B中含有官能团的名称有:醛基、碳碳双键,
故答案为:醛基、碳碳双键;消去反应;
(3)B为 ,含有官能团有:醛基、碳碳双键,检验醛基可以用银氨溶液或新制氢氧化铜,检验碳碳双键只能用溴水,不能用酸性高锰酸钾,因为苯环上的异丙基也能够使酸性高锰酸钾褪色,故答案为:AC;
,含有官能团有:醛基、碳碳双键,检验醛基可以用银氨溶液或新制氢氧化铜,检验碳碳双键只能用溴水,不能用酸性高锰酸钾,因为苯环上的异丙基也能够使酸性高锰酸钾褪色,故答案为:AC;
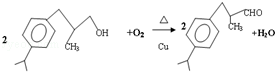
(4)在Cu作催化剂、加热条件下,C发生氧化反应生成兔耳草醛,反应方程式为 ,
,
故答案为: ;
;
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应,说明不含醛基但含有羟基;b.
核磁共振氢谱显示:Y消去反应产物的环上只存在一种化学环境的氢原子,说明Y发生消去反应产物的环上只有一种类型氢原子,Y可能的结构简式为 、
、 ,
,
故答案为: ;
; .
.
点评 本题考查有机物推断,为高考高频点,根据反应条件、部分有机物结构简式结合题给信息进行推断即可,侧重考查学生分析推断及知识迁移能力,明确醛之间发生加成反应时断键和成键方式,难点是同分异构体种类判断,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{32}$ mol-1 | B. | 16m mol-1 | C. | m mol-1 | D. | 32m mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C (s)+O2(g)=CO (g)△H=-110.5 kJ/mol | |
| B. | C (s)+O 2(g)=CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有较强酸性和还原性 | 易溶于水,难溶于乙醇 |
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com