
能够使反应Cu+2H2O====Cu(OH)2+H2↑发生的是( )
A.用铜片作阴、阳极,电解氯化铜溶液
B.用铜片作阴、阳极,电解硫酸钾溶液
C.铜锌合金在潮湿空气中发生电化学腐蚀
D.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
科目:高中化学 来源: 题型:
大气中的部分源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)===IO-(aq)+O2(g) ΔH1;
②IO-(aq)+H+(aq)  HOI(aq) ΔH2;
HOI(aq) ΔH2;
③HOI(aq)+I-(aq)+H+(aq)  I2(aq)+H2O(l) ΔH3。
I2(aq)+H2O(l) ΔH3。
总反应的化学方程式为______________________________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I
I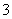 (aq),其平衡常数表达式为______________。
(aq),其平衡常数表达式为______________。
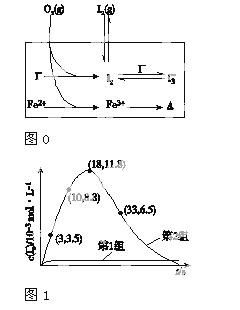
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图0),某研究小组测定两组实验中I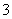 浓度和体系pH,结果见图1和下表。
浓度和体系pH,结果见图1和下表。
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是__________________________________
________________________________________________________________________。
②图中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是
________________________________________________________________________
________________________________________________________________________。
③第2组实验进行18 s后,I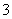 浓度下降。导致下降的直接原因有(双选)________。
浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小
C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图1,计算3~18 s内第2组实验中生成I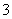 的平均反应速率(写出计算过程,结果保留两位有效数字)。
的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液的pH值变化范围较小,pH值只能在7.0~7.8的范围内变化,否则将会有生命危险。实验证明,在50 mL的血液中加入1滴(0.05 mL)10 mol·L-1 的盐酸时,pH值由7.4降至7.2,如果向50 mL、pH值为7.4的NaOH溶液中加入1滴(0.05mL)10 mol·L-1盐酸时,pH值大约将变为 。显然,人体血液具有 的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,难溶化合物饱和溶液的离子浓度的乘积为一常数,这个常数用
在一定温度下,难溶化合物饱和溶液的离子浓度的乘积为一常数,这个常数用 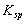 表示。已知:
表示。已知: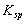 (AgCl) = = 1.8×10-10;
(AgCl) = = 1.8×10-10;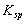 (Ag2CrO4) = 2 = 1.9×10-12
(Ag2CrO4) = 2 = 1.9×10-12
现有0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42- 哪种先沉淀?
(2)当CrO42- 以 Ag2CrO4 形式沉淀时,溶液中的Cl- 离子浓度是多少? CrO42- 与Cl- 能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5 mol·L-1 时,则认为可以达到有效分离)
查看答案和解析>>
科目:高中化学 来源: 题型:
用碳棒作电极,在Na+、Cu2+、Cl-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是___________________;
(2)当阴极析出金属,阳极放出O2时,电解质是________________;
(3)当阴极放出H2,阳极放出Cl2时,电解质是_________________;
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极析出的气体的物质的量之比为4:2:1时,电解质的化学式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作或发生事故时的处理方法正确的是( )
|
| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 |
|
| B. | 给试管里的液体加热时,试管应与桌面垂直 |
|
| C. | 配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线 |
|
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
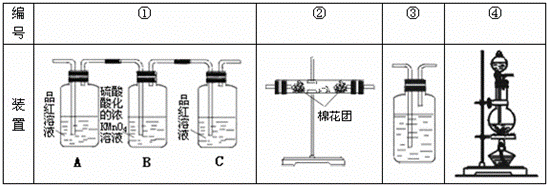
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号): → → → .
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 .
(4)装置②中所加固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 ,可验证的产物是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4.请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 .
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 .
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.写出A与X的溶液反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com