
向水中加入等物质的量Ag+、Na+、Pb2+、Cl﹣、SO42﹣、NO3﹣,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为()
A. 8:1 B. 2:1 C. 1:1 D. 1:2
考点: 电解原理.
分析: 在纯水中加入物质的量相等的Ag+、Na+、Pb2+、Cl﹣、SO42﹣、NO3﹣,Ag+、Cl﹣反应生成AgCl沉淀,Pb2+和SO42﹣生成PbSO4沉淀,所以溶液中的溶质是NaNO3,用惰性电极电解硝酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,结合电解方程式计算.
解答: 解:在纯水中加入物质的量相等的Ag+、Na+、Pb2+、Cl﹣、SO42﹣、NO3﹣,Ag+、Cl﹣反应生成AgCl沉淀,Pb2+和SO42﹣生成PbSO4沉淀,所以溶液中的溶质是NaNO3,用惰性电极电解硝酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,氧化产物是氧气、还原产物是氢气,电解方程式为2H2O 2H2↑+O2↑,
2H2↑+O2↑,
氧化产物与还原产物物质的量之比1:2,
故选D.
点评: 本题以电解原理考查了离子共存、离子放电顺序,明确溶液中的溶质及离子放电顺序是解本题关键,很多同学往往漏掉离子共存而导致错误,为易错点.


科目:高中化学 来源: 题型:
(1)在25℃、101kPa的条件下,同质量的CH4和A气体的体积之比是11:4,则A的摩尔质量为 .
在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 mol/L,SO42﹣的物质的量浓度为 mol/L.
(3)将5.3gNa2CO3溶于水配成1L溶液,要使Na+浓度变为0.2mol/L,需要加入NaCl固体 g
(4)实验测得CO和O2混合气体的密度是氢气的15.5倍,其中氧气的体积分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 摩尔是6.02×1023个结构微粒的集体 |
|
| B. | 0.012kg12C所含的原子数精确值是6.02×1023 |
|
| C. | 1molH就是1mol氢 |
|
| D. | 1molH2SO4的质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用NaOH固体配制480mL 1.0mol/L的NaOH溶液,请回答下列问题:
(1)应称取NaOH固体的质量 g
(2)实验仪器除了托盘天平、药匙、烧杯、玻璃棒外,还应有
(3)容量瓶上需标有以下五项中的 (序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)使用容量瓶前必须进行的一步操作是 .
(5)配制时,其正确的操作顺序是
A、用30mL水洗涤烧杯2﹣3次,洗涤液均转入容量瓶,振荡
B、用托盘天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
(6)下列配制的溶液浓度偏大的是
A、NaOH在烧杯中溶解后,未冷却就转移到容量瓶中
B、向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C、未洗涤溶解NaOH的烧杯
D、定容时俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是()
A. Na2CO3NaHCO3NaClNH4Cl B. Na2CO3NaHCO3NH4ClNaCl
C. (NH4)2SO4NH4ClNaNO3Na2S D. NH4Cl(NH4)2SO4Na2SNaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0,下列研究目的和示意图相符的是()
A B C D
研究目的 压强对反应的影响
(p2>p1) 温度对反应的影响 平衡体系增加O2的浓度对反应的影响 体积恒定的密闭容器中催化剂对反应的影响
图示 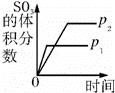
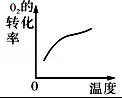
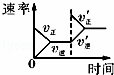

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学降解NO3﹣的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左﹣△m右)为a克,则a值为()
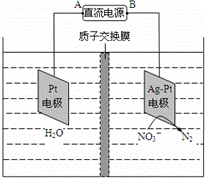
A. 14.4 B. 10.4 C. 12.4 D. 14.0
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
|
| A. | 元素原子的核外电子排布呈周期性变化 |
|
| B. | 元素的原子半径呈周期性变化 |
|
| C. | 元素的化合价呈周期性变化 |
|
| D. | 元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol,
②H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ/mol,
O2(g)=H2O(g)△H=﹣241.8kJ/mol,
③C(g)+ O2(g)=CO (g)△H=﹣110.5KJ/moL,
O2(g)=CO (g)△H=﹣110.5KJ/moL,
④C(s)+O2(g)=CO2(g)△H=﹣393.5KJ/moL.回答下列各问:
(1)上述反应中属于放热反应的是
(2)C的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为 .
(4)CO的燃烧热为 ,表示CO燃烧热的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com