
| A、工业生产合成氨时一般选择在500℃的温度下进行 |
| B、H2、I2、HI混合气体加压后颜色变深 |
| C、合成氨时采用循环操作,可提高原料的利用率 |
| D、红棕色的NO2加压后颜色先变深再变浅 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、油脂水解的产物是水和CO2 |
| B、油脂水解可得到丙三醇 |
| C、淀粉水解的最终产物是葡萄糖 |
| D、蛋白质水解的最终产物是氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2V酸=V碱 |
| B、V酸=2V碱 |
| C、V酸=102V碱 |
| D、102V酸=V碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有饱和NaCl溶液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有饱和NaCl溶液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁棒连接直流电源的正极,石墨连接直流电源的负极 |
| B、溶液中的OH-离子向阳极移动,阳极周围显红色 |
| C、跟直流电源正极相连的电极上产生能使KI淀粉溶液变蓝的气体 |
| D、跟直流电源负极相连的电极上发生氧化反应,产生无色可以燃烧的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲容器中NH3(g)的体积分数比乙容器中的小 | ||
B、平衡时甲容器中气体的压强为开始时压强的
| ||
| C、达到平衡时,甲容器中H2的转化率为25% | ||
D、Q1=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L |
| B、0.5 mol/L |
| C、0.01mol/L |
| D、0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
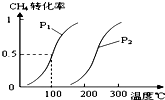 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| ⅰ | 150 |
| 0.1 | ||
| ⅱ | 5 | ||||
| ⅲ | 350 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com