
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
分析 在相同的温度下,按化学计量转化到一边,对应成分的物质的量相同,平衡时各成分的百分含量相同,两平衡是等效平衡;
据此计算从SO3开始进行反应,达相同的平衡状态,混合气体的压强比起始时增大了20%,计算平衡时SO2的物质的量;
根据从SO2和O2起始达平衡时,据此计算平衡时消耗n(SO2),得到二氧化硫的转化率.
解答 解:在相同的温度下,按化学计量转化到一边,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,2molSO2和1molO2完全转化,可得n(SO3)=n(SO2)=2mol,故从SO3开始进行反应,达相同的平衡状态,需要SO3的物质的量为2mol,对应成分的物质的量相同,所以说明两平衡是等效平衡;
若开始时只充入2mol SO3,达到平衡时,混合气体的压强比起始时增大了20%,设生成二氧化硫物质的量x,
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) 0 0 2
变化量(mol) x 0.5x x
平衡量(mol) x 0.5x 2-x
压强之比等于气体物质的量之比,x+0.5x+2-x=2+2×20%,
解得:x=0.8mol;
若开始时只充入了2mol SO2和1mol O2的混合气体,达到平衡状态消耗二氧化硫物质的量=2mol-0.8mol=1.2mol,
所以达到平衡时SO2的转化率为:$\frac{1.2mol}{2mol}$×100%=60%,
故选C.
点评 本题考查了化学平衡的计算应用,题目难度中等,明确等效平衡的判断方法为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 水中 溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的所有碳原子不在同一条直线上 | |
| B. | 在光照条件下,可与Cl2发生取代反应 | |
| C. | 丙烷的沸点比丁烷的沸点高,更易液化 | |
| D. | 丙烷难溶于水,且密度小于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10mL 1mol/L的甲酸溶液恰好与10mL 1mol/L的NaOH溶液完全反应 | |
| D. | 在相同温度下,物质的量浓度相同的甲酸导电性比硫酸弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
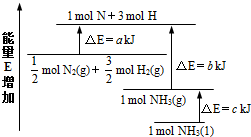 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com