
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4 和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g)![]() 2CH3OH(g) △H=_____。
2CH3OH(g) △H=_____。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是_____。
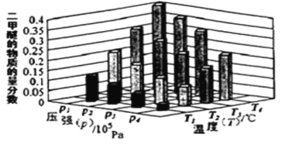
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=_________;反应达到平衡状态时,测得二氧化碳为 0.8mol,则平衡时的压强为起始压强的_________倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH_____0(填“>”、“<”)
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K= ______。
(5)利用原电池反应可实现NO2 的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH ____(填“变大”、“变小”或“不变”),负极电极反应式为 ____。
【答案】312kJ/mol BC 0.075mol/(L·min) 0.89 < 1.8 变大 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)根据CH4和CH3OH的燃烧热书写二者热化学方程式,结合盖斯定律进行计算;
(2)根据温度、压强等外界条件对平衡移动的影响及图中数据变化进行分析判断;
(3)①根据CO转化率计算消耗CO的物质的量,根据v =![]() 计算v(CO),再根据速率之比等于化学计量数之比计算v(N2);恒温恒容时,压强之比等于物质的量之比;
计算v(CO),再根据速率之比等于化学计量数之比计算v(N2);恒温恒容时,压强之比等于物质的量之比;
②由△H-T△S<0及反应中熵的变化来判断;
(4)相同条件下体积之比等于物质的量之比,列三段式计算;
(5)正极上是二氧化氮得到电子发生还原反应,负极是氨气失电子发生氧化反应,结合电极反应分析判断。
(1)CH4和CH3OH的燃烧热分别是784kJ/mol和628kJ/mol则①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-784kJ/mol,②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-628kJ/mol,结合盖斯定律(①-②)2得到热化学方程式2CH4(g)+O2(g)=2CH3OH(g)△H=-312kJ/mol,答案为:-312kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H=-628kJ/mol,结合盖斯定律(①-②)2得到热化学方程式2CH4(g)+O2(g)=2CH3OH(g)△H=-312kJ/mol,答案为:-312kJ/mol;
(2)由图可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应为放热反应,则温度越高二甲醚的质量分数越小,所以温度:T1>T2>T3>T4;正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大,故压强:p1>p2>p3>p4,答案选:BC;
(3)①消耗CO物质的量为2.0mol30%=0.6mol,v(CO)= =0.15 mol/(Lmin),速率之比等于化学计量数之比,所以v(N2)=
=0.15 mol/(Lmin),速率之比等于化学计量数之比,所以v(N2)=![]() v(CO)=0.075 mol/(L·min);开始通入1.5molNO 和 2.0molCO,反应达到平衡状态时,测得二氧化碳为 0.8mol,列三段式为:
v(CO)=0.075 mol/(L·min);开始通入1.5molNO 和 2.0molCO,反应达到平衡状态时,测得二氧化碳为 0.8mol,列三段式为:

恒温恒容时,气体的压强之比等于物质的量之比,所以平衡时的压强为起始时压强的![]() =0.89,答案为:0.075 mol/(L·min);0.89;
=0.89,答案为:0.075 mol/(L·min);0.89;
②正反应为气体物质的量减小的反应,为熵减小的反应,即△S<0,而△H-T△S<0反应能自发进行,该反应在低温下能自发进行,所以该反应的△H<0;
(4)相同条件下体积之比等于物质的量之比,设NO2与SO2的物质的量分别为1mol、2mol,容器体积为1L,则NO2与SO2的初始浓度分别为1mol/L、2mol/L,列三段式为:
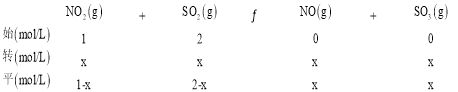
达到平衡时SO3的体积分数为25%,则![]() 100%=25%,解得x=0.75,该反应的平衡常数K=
100%=25%,解得x=0.75,该反应的平衡常数K=![]() =1.8;
=1.8;
(5)原电池工作时,负极发生氧化反应,正极发生还原反应,根据电池总反应6NO2+ 8NH3=7N2+12H2O,可知正极上是二氧化氮得到电子发生还原反应,电极反应式为:2NO2+8e-+4H2O=N2+8OH-,产生OH-,c(OH-)变大,pH变大;NH3在负极失去电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,答案为:变大;2NH3-6e-+6OH-=N2+6H2O。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是
A.2Na+2H2O=2NaOH+H2↑B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物 H 的路线如图所示。
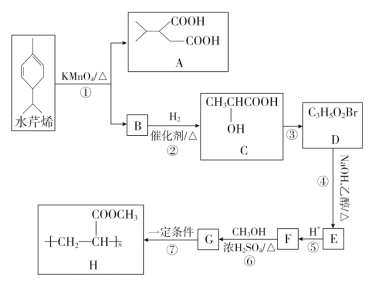
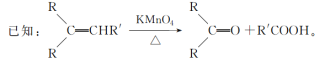
回答下列问题:
(1)B 的结构简式为________,G 的结构简式是________。
(2)反应③的反应试剂和反应条件分别是________,反应④的反应类型是________。
(3)反应⑥的化学方程式为________,反应⑥中浓 H2SO4 的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质的转化关系中,A是一种固体物质,E是一种白色沉淀,据此填写下列空白:
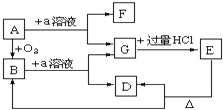
(1)B的化学式是________,B在固态时属于________晶体,1mol 含有的共价键数目是______NA。
(2)E的化学式是_________。
(3)B和a溶液反应的离子方程式是_______________________________
(4)A和a溶液反应的化学方程式是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种电池的电池反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-=Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质溶液
D.放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了制取焦亚硫酸钠(![]() ),并对其性质进行研究。特进行如下实验:
),并对其性质进行研究。特进行如下实验:
实验一 制取焦亚硫酸钠。
研究小组采用下图装置(实验前已除尽装置内的空气)制取![]() 。装置Ⅱ中有
。装置Ⅱ中有![]() 晶体析出,发生的反应为:
晶体析出,发生的反应为:![]() 。
。
(1)装置Ⅰ中通常采用70%~80%的浓硫酸与亚硫酸钠固体反应制取![]() ,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
(2)若要从装置Ⅱ中获得已析出的晶体,所采取的分离方法需用到的玻璃仪器有________。
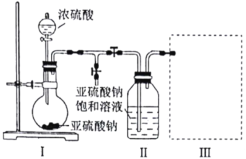
(3)装置Ⅲ用于处理尾气,请画出用来处理尾气并防止发生倒吸的实验装置,注明相应的试剂。
____________________________________________________________
(4)已知![]() 溶于水后,立即生成
溶于水后,立即生成![]() ,该反应的离子方程式为________________________。
,该反应的离子方程式为________________________。
(5)用![]() 试纸测得
试纸测得![]() 溶液呈酸性,其溶液呈酸性的原因是________________________。
溶液呈酸性,其溶液呈酸性的原因是________________________。
(6)取少量焦亚硫酸钠晶体于试管中,其中滴加酸性![]() 溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生
溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生![]() ,该反应的离子方程式是________________________。
,该反应的离子方程式是________________________。
实验三 焦亚硫酸钠的含量测定。
测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知:![]() ;
;![]() 。
。
①精确称取干燥的产品![]() 放入碘量瓶(带磨口塞的锥形瓶)中。
放入碘量瓶(带磨口塞的锥形瓶)中。
②向碘量瓶中准确移取![]() ,
,![]() 的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
③加入![]() 淀粉溶液,用标准
淀粉溶液,用标准![]() 溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为
溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为![]() 。
。
(7)上述实验操作滴定终点的现象为________________________;根据上述实验,计算产品中焦亚硫酸钠的质量分数为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com