
| A. | 通入澄清的石灰水 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 通入品红溶液 | D. | 通入CaCl2溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B的浓度降低 | D. | C的体积分数下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 | |
| B. | ②图象中纵坐标可以为镓的转化率 | |
| C. | ③图象中纵坐标可以为化学反应速率 | |
| D. | ④图象中纵坐标可以为体系内混合气体平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
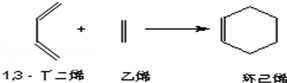
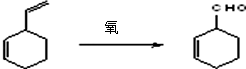
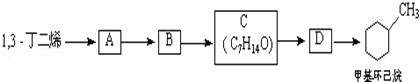
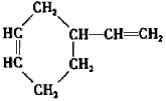 ;B
;B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com