
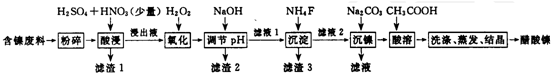
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaS04 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
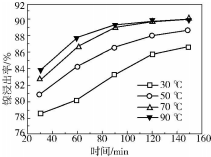
分析 含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;
(1)调节pH使Al3+、Fe3+转化为沉淀,根据表中的数据分析;
(2)根据流程分析;
(3)加H2O2把亚铁离子氧化为Fe3+;
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2;
(5)已知NiCO3的Ksp=9.6×10-4,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol•L-1],求出碳酸根离子的浓度,然后求出其物质的量和质量;
(6)根据图象中不同温度、时间下酸浸出率分析.
解答 解:含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;
(1)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;
故答案为:5.0≤pH<6.7;
(2)由流程分析可知,滤渣1为二氧化硅和硫酸钙,滤渣3为CaF2;
故答案为:SiO2、CaSO4;CaF2;
(3)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,起反应的离子方式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的化学方程式为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
故答案为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
(5)已知NiCO3的Ksp=9.6×10-4,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol•L-1],
则溶液中c(CO32-)=$\frac{Ksp}{c(N{i}^{2+})}$=$\frac{9.6×1{0}^{-4}}{1{0}^{-5}}$mol/L=96mol/L,与Ni2+反应的n(CO32-)=cV=2mol/L×0.1L=0.2mol,
则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+96mol/L×0.1L=9.8mol,
所以m=nM=9.8mol×106g/mol=1038.8g,
故答案为:1038.8;
(6)由图象可知,为70℃、120min时,酸浸出率最高,故答案为:70;120.
点评 本题考查了物质分离提纯基本操作和综合应用、溶度积常数的有关计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握常见物质或离子的分离提纯方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl的浓度为0.12mol•L-1,则H2的反应速率为:0.015mol/(L•min) | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率变大 | ||
| C. | 物质B的质量分数增加 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
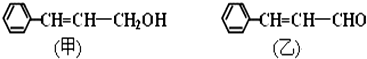
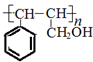 .
.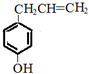 .
.
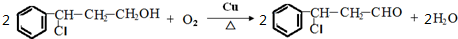 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X 的最高价氧化物对应的水化物酸性最强 | |
| B. | 化合物XY2、ZY2均能溶于水生成含氧酸 | |
| C. | Y的氢化物比W的氢化物沸点高 | |
| D. | 四种元素中W原子半径最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com