
��8�֣�A��B��Ϊ��ɫ����Һ��B����ɫ��Ӧ�ʻ�ɫ��һ��������A��B���Է���ͼ��E��F��Ϊ�д̼�����ζ�����壬 H�������ᣬʾ������֮���һϵ�б仯��
����д���пհס�
(1)����F�Ļ�ѧʽΪ ��C�����ʵĻ�ѧʽΪ ��
(2)д�����з�Ӧ�����ӷ���ʽ��
C��E �� D+G��H ��
(3) �ڻ����ҺG�������뼸��ʯ����Һ���ɼ�����Ϊ ��ԭ����_______________________________���û�ѧ����ʽ��ʾG��Һ���γɹ��̣�
��8�֣�(1) SO2, NaCl ��2�֣�
��2����2Cl-+2H2O Cl2��+H2��+2OH- ��1�֣�
Cl2��+H2��+2OH- ��1�֣�
��BaSO3+2H++SO42-=BaSO4+SO2��+H2O��2�֣�
(3)���ɫ��1�֣���SO2+Cl2+2H2O��2HCl+H2SO4��2��
�������������B����ɫ��Ӧ�ʻ�ɫ��˵�����������ӡ�E��F��Ϊ�д̼�����ζ�����壬��E�������ĵ缫�������EӦ������������C�������Ȼ��ơ�D�����ᷴӦ����F������F�����Ƕ�������D�����������ᱵ�������Ѷ������������������ᣬ��G�����ᡣG��A��Ӧ����H����������A���Ȼ�����H�����ᱵ����B���������ơ�
���㣺��������ͼ��
��������ѧ�ƶ�����һ���ۺ��Խ�ǿ�����⣬��Ԫ�ؼ����������ʺ�������������������ѧ�����֪ʶ����������ѧ�Ƽ��ۺϡ��������ɿ���ѧ���Ի�ѧ֪ʶ������̶ȣ�����Ҫ��������ѧ�����ۺϷ���������˼ά���������ͼ��ķ�������ؼ�����Ѱ�ҡ�ͻ�ƿڡ�����ͻ�ƿڡ�����ץ���ء��֣�����������ɫ������״̬��������ζ�����ⷴӦ���������������Ʒ���������;�ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010������е���У�������Ĵθ߿�ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
(14��)��ͼ��ʾ�й�����֮���ת����ϵ������A��B��Ϊ��ɫ����Һ��B����ɫ��Ӧ�ʻ�ɫ��F���γ��������Ⱦ��֮һ��H������ˮ�Ҳ�����ϡ���ᡣ(���ֲ�����ȥ)
��1��A��B��E��F���������ʷֱ�Ϊ �� �� �� (�ѧʽ)��
��2����Ӧ�ٵ����ӷ�Ӧ����ʽΪ ��
��3����E��F�����ʵ���֮��Ϊn(E) : n(F)��1:1�����ڻ����ҺG�е��뼸��ʯ��
: n(F)��1:1�����ڻ����ҺG�е��뼸��ʯ��
��Һ���ɹ۲쵽������Ϊ ��
��4����E��F�����ʵ���֮��1:1������з��������ӷ�Ӧ����ʽΪ
��
��5�����з����ķ�Ӧ���ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��8�֣�A��B��Ϊ��ɫ����Һ��B����ɫ��Ӧ�ʻ�ɫ��һ��������A��B���Է���ͼ��E��F��Ϊ�д̼�����ζ�����壬 H�������ᣬʾ������֮���һϵ�б仯��
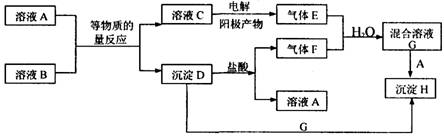
����д���пհס�
(1)����F�Ļ�ѧʽΪ ��C�����ʵĻ�ѧʽΪ ��
(2)д�����з�Ӧ�����ӷ���ʽ��
C��E �� D+G��H ��
(3) �ڻ����ҺG�������뼸��ʯ����Һ���ɼ�����Ϊ ��ԭ����_______________________________�� �û�ѧ����ʽ��ʾG��Һ���γɹ��̣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com