
A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式
。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+
时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A. =0.8 mol·L-1 B. =1.4 mol·L-1 C. <1.4 mol·L-1 D. >1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A. 0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C. 1.0 mol、2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体②X的种类比Y的多
③沸点:A的氢化物小于C的氢化物
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④

查看答案和解析>>
科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O;△H =一57.3kJ/mol。分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系表示正确的是( )
A.△H1>△H2>△H3 B.△H2<△H3<△H1
C.△H1=△H2=△H3 D.△H2>△H3>△H1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的Fe和Fe2O3混合物投入1 mol·L-1 300 mL的HNO3溶液中,反应完全后,无固体剩余,生成1.12 LNO气体(标准状况),再向反应后溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.200mL B.245mL C.250mL D.300mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氯气有毒,不能用来给自来水消毒
B.甲烷燃烧会生成CO2,因此不属于清洁能源
C.铝合金的密度小,硬度大,可用作建筑材料
D.石英玻璃耐强酸强碱,可用来制造化学仪器
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: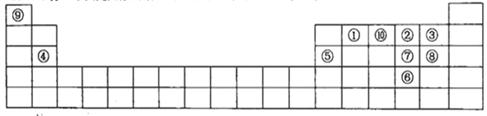
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为______________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
(6)元素④和③形成的化合物属于 化合物,用电子式表示其形成过程 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com