
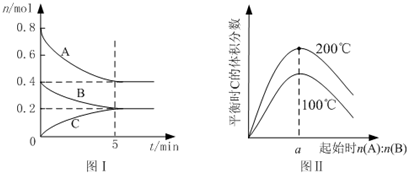
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)+Q(Q>0) | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 由图I可知,该反应式为2A(g)+B(g)?C(g) |
分析 A.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(B);
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;
C.恒温恒容条件下通入氦气,反应混合物的浓度不变,平衡不移动;
D.根据图1中物质的量变化与化学计量数成正比判断计量数,然后写出反应的方程式.
解答 解:A.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02 mol•L-1•min-1,故A错误;
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,正确热化学方程式为:xA(g)+yB(g)?zC(g)-Q(Q>0),故B错误;
C.恒温恒容条件下,通入氦气后各组分的浓度不变,则化学平衡不移动:v(正)=v(逆),故C错误;
D.根据图1可知,200℃时平衡时,A的物质的量减少:0.8mol-0.4mol=0.4mol,B的物质的量减少:0.4mol-0.2mol=0.2mol,C的物质的量增大0.2mol,则该反应方程式为:2A(g)+B(g)?C(g),故D正确;
故选D.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学平衡图象、反应速率计算、影响化学平衡的因素、化学平衡有关计算等知识,注意C选项中稀有气体对化学平衡移动的影响,试题培养了学生的分析能力及灵活应用能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 镀锡铁制品镀层破损后铁不易被腐蚀 | |
| B. | 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同 | |
| C. | 向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2] | |
| D. | 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和H2O2溶液在试管中混合后,加入苯萃取,振荡,静置 | 上层溶液呈紫红色 | 氧化性:H2O2>I2 |
| B | 将刚刚用砂纸打磨过的铝箔放在酒精灯上加热 | 铝箔熔化,但不滴落 | 铝易被氧化;铝的熔点比氧化铝低 |
| C | 常温下,用pH试纸测量某浓度的NaHSO3溶液的pH | pH约为5.5 | 该溶液中的HSO3-的电离程度大于它的水解程度 |
| D | 向盛Mg(OH)2悬浊液的试管中加入适量NH4Cl浓溶液 | 溶液变澄清 | Mg(OH)2与NH4Cl溶液发生氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2→CO2+2H2O | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物 | |
| B. | 将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化 | |
| C. | “雷雨发庄稼”的实质是自然固氮 | |
| D. | 自来水厂可用明矾对水进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp3杂化 | |
| C. | 氯化硼分子属极性分子 | |
| D. | 氯化硼遇水蒸气会产生白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com