
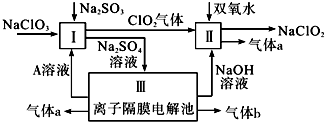
分析 硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,以此解答该题.
解答 解:硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;
(1)Na2SO3具有还原性,可与酸性高锰酸钾发生氧化还原反应,滴定终点现象是无色到浅紫红色且半分钟不褪,故答案为:无色到浅紫红色且半分钟不褪;
(2)碱性条件下,ClO2、H2O2发生氧化还原反应生成氧气、ClO2-和水,离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O;
(3)通过以上分析知,电解硫酸钠溶液,阳极上氢氧根离子放电生成氧气,同时生成硫酸,所以A是硫酸,阴极上生成氢气同时阴极附近生成NaOH,
故答案为:H2SO4;阴极.
点评 本题考查制备实验方案设计,为高频考点,明确I、II、III中发生的反应及物质的性质是解本题关键,熟悉常见物质的性质,难点是离子方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与Na2S03溶液加足量稀HNO3 | |
| B. | Ba(0H)2溶液与KN03溶液加足量稀H2SO4 | |
| C. | AgN03溶液与Na2C03溶液加足量稀盐酸 | |
| D. | Ca(0H)2溶液与FeCl3溶液加足量稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
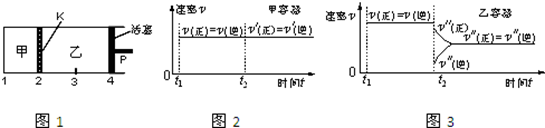
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
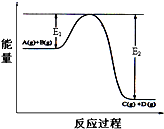 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
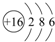 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com