
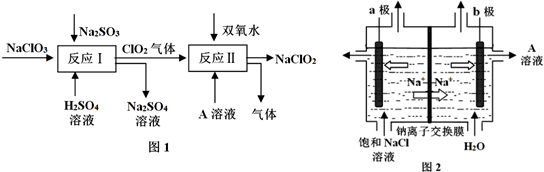
分析 由NaClO2生产的主要流程(图1)可知,反应Ⅰ的反应物为NaClO3、Na2SO3、硫酸,反应产生ClO2、Na2SO4溶液,反应离子方程式为2H++SO32-+2ClO3-=2ClO2+SO42-+H2O,Ⅱ中生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),由图2钠离子向阴极移动,b为阴极,氢离子在阴极放电生成氢气,同时生成A为NaOH,发生反应为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;
图2装置,用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,Cl失去电子被氧化,应在阳极上生成;ClO2将CN-氧化,离子反应方程式为2ClO2+2CN-═N2↑+2CO2↑+2Cl-,根据方程式计算需要ClO2的物质的量,然后结合V=nVm计算.
解答 解:(1)I中发生2H++SO32-+2ClO3-=2ClO2+SO42-+H2O,Cl元素的化合价降低,S元素的化合价升高,则氧化剂为NaClO3,还原剂为Na2SO3,由反应可知氧化剂与还原剂的物质的量之比为2:1,故答案为:2:1;
(2)由图2钠离子向阴极移动,b为阴极,氢离子在阴极放电生成氢气,同时生成A为NaOH,Ⅱ中生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),发生反应为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,离子反应为2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O,
故答案为:NaOH;2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O;
(3)Cl失去电子被氧化,应在阳极上生成,由(2)可知,b为阴极,a为阳极,电极反应为Cl-+2H2O-5e-═ClO2+4H+,故答案为:a极;Cl-+2H2O-5e-═ClO2+4H+;
(4)100m3废水中CN-质量=100×103×m3×650mg/m3=65×106 mg=65×103g,CN-的物质的量为$\frac{65×1{0}^{3}g}{26g/mol}$=2.5×103mol,由2ClO2+2CN-═N2↑+2CO2↑+2Cl-可知,至少需要ClO2的物质的量为2.5×103mol,其标况下体积为2.5×103mol×22.4L/mol=56000L,故答案为:56000.
点评 本题考查物质的制备实验,为高频考点,把握制备流程中的反应、电解原理及应用等为解答的关键,侧重分析与应用及计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
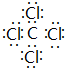 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑨ | B. | ①②⑤⑥⑧ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 用氢氧化铜粉末检验尿糖 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com