
富马酸亚铁(分子式为C4H2O4Fe,结构简式为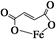 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图: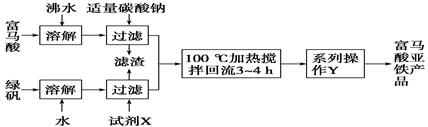
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
(1)①HOOCHC===CHCOOH
②Fe2(SO4)3和Fe(OH)3
③蒸发浓缩
④取洗涤液,向其中加入少量盐酸酸化后再加入氯化钡溶液,无白色沉淀生成
(2)②取少量滤液,滴加KSCN溶液,不显血红色
③再向上述溶液中滴加H2O2溶液,溶液显血红色
解析试题分析:(1)①由富马酸亚铁的结构简式可推断富马酸的结构简式为HOOCHC===CHCOOH,②由于亚铁离子不稳定,容易被氧化成三价铁离子,铁离子在溶液中会发生水解,生成氢氧化铁,所以绿矾(FeSO4?7H20)在保存过程中形成的杂质主要有硫酸铁、氢氧化铁等杂质③得到的含有富马酸亚铁的溶液需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最后得到富马酸亚铁产品;④富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验.所以检验方法是:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净.
(2)检验亚铁离子的方法:滴加硫氰化钾溶液,溶液没有变成红色,证明溶液中没有三价铁离子;然后加入氧化剂将亚铁离子氧化成三价铁离子,溶液变成红色,证明原溶液中存在亚铁离子,结合题给试剂故答案为:
考点:本题以实验室模拟工业制取富马酸亚铁为载体,考查了有机物结构简式的书写、Fe3+的水解性、Fe2+的还原性及检验知识.步骤 实验操作与现象 ① 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 ② 取少量滤液,滴加KSCN溶液,不显血红色 ③ 再向上述溶液中滴加H2O2溶液,溶液显血红色


科目:高中化学 来源: 题型:实验题
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石 b.饱和氯化钙溶液 c.6 mol/L盐酸 d.氯化铵 e.氢氧化钙
(1)A中制备气体时,所需药品是(选填字母序号) ;
(2)B中盛有饱和碳酸氢钠溶液,其作用是 ;
(3)写出制取氨气的化学方程式 ;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式 ;
(5)检验D出口处是否有氨气逸出的方法是 ;
(6)写出制纳米级碳酸钙的化学方程式 。
(7)若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
试回答:
(1)所加试剂A的化学式为
(2)B操作方法是
(3)样品中氯化铵的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: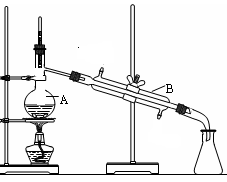
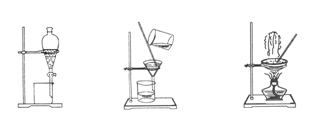
图1 图2 图3 图4
(1)装置图1中A的名称是________,B的名称是 。A 中一般要加入碎瓷片,其作用是 。装置图4中盛溶液的仪器名称是 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: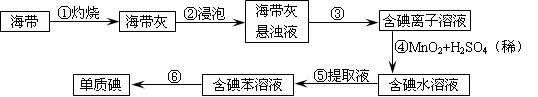
1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是______________________________。
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、 ___、 。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO4¯+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是 。
②计算上述样品中FeSO4·7H2O的质量分数为 _(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl)。某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤取滤液;③蒸发滤液;④冷却结晶。
(1)在操作①、②、③中均用到玻璃棒,该仪器的目的依次是 、 、 。
(2)为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等份:
①取一份溶液,加入适量HCl,观察到 ,证明含有碳酸根。
②取另一份溶液,为检验SO42-,应往溶液中加入 。
③取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl-。你认为该生所得的结论是否严密? 。为什么? 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1MgSO4溶液和0.5mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL四口烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是 。
②步骤3生成MgCO3·nH2O沉淀的离子方程式为 。
③步骤4检验是否洗涤干净的方法是 。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。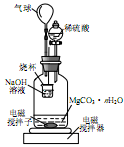
①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
(3)称取100g上述晶须产品进行热重分析,热重曲线如图。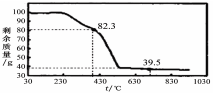
则该条件下合成的晶须中,n= (选填:1、2、3、4、5)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________ __,漂白粉的有效成分为 。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 | 现象: 结论: |
| 步骤3:取滤液分装A、B两支试管。向A试管, | 现象:溶液先变红色,然后褪色。 结论: |
| 步骤4:向B试管, | 现象:产生白色沉淀。 结论: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com