
【题目】部分短周期元素原子的最外层电子数与原子序数的关系如图所示,下列说法正确的是 ( )
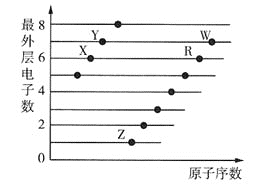
A.X、Y、Z、R、W五种元素的最高正化合价均等于其族序数
B.同周期元素中,W的电负性最大,Z的第一电离能最大
C.R、W所形成的氧化物的水化物的酸性强弱为![]()
D.X、Y、R、W四种元素形成的简单氢化物中最稳定的是Y的简单氢化物
【答案】D
【解析】
由图可知,X、Y位于第二周期,Z、R、W位于第三周期,X元素原子的最外层电子数为6,则X为O,Y元素原子的最外层电子数为7,则Y为F,Z、R、W元素原子的最外层电子数分别为1、6、7,则Z为Na,R为S,W为Cl。
A.O没有![]() 价,F没有
价,F没有![]() 价,故A错误;
价,故A错误;
B.一般来说,同周期元素从左到右,随着原子序数的增大,电负性越来越大,第一电离能呈增大趋势,故第三周期元素中,Cl的电负性最大,Na的第一电离能最小,故B错误;
C.HClO为弱酸,而![]() 为强酸,未说明最高价氧化物对应水化物,故C错误;
为强酸,未说明最高价氧化物对应水化物,故C错误;
D.O、F、S、Cl四种元素中F的非金属性最强,则四种元素形成的简单氢化物中最稳定的是HF,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
(1)铅蓄电池在放电时的电池反应为Pb+PbO2+2H2SO4==2PbSO4+2H2O,则其正极上的电极反应为___________。
(2)FeCl3溶液腐蚀印刷电路铜板时发生反应:2FeCl3+Cu==2FeCl2+ CuCl2。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:_________。
(3)用Fe做阳极,KOH溶液做电解质溶液,进行电解,在阳极得到FeO![]() ,写出阳极的电极反应式____________________________________
,写出阳极的电极反应式____________________________________
(4)已知甲醇燃料电池的工作原理如下图所示。该电池工作时,b口通入的物质为_____,该电池正极上的电极反应式为 _______________;当6.4g甲醇(CH3OH)完全反应生成CO2时,有____mol电子发生转移。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温常压下,N2(g)+3H2(g ) 2NH3(g) △H=-92.4 kJ /mol在同温同压下向一密闭容器中通入1molN2和3molH2,反应完后放出热量为Q1 kJ,向另一个体积相同的密闭容器通入2molNH3,相同条件下反应完成时吸收热量为Q2 kJ,且Q2=3Q1则下列说法正确的是( )
A.Q1=92.4 kJ B.Q1+Q2=92.4
C.H2的转化率为75%D.两个容器中NH3的百分含量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为![]() 的元素一定是副族元素
的元素一定是副族元素
C.某主族元素的电离能![]() 数据如下表所示
数据如下表所示![]() 单位:
单位:![]() ,可推测该元素位于元素周期表第ⅤA族
,可推测该元素位于元素周期表第ⅤA族

D.在①P、S ,②![]() 、Ca,③
、Ca,③![]() 、F三组元素中,每组中第一电离能较大的元素的原子序数之和为36
、F三组元素中,每组中第一电离能较大的元素的原子序数之和为36
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.元素的第一电离能越大,其金属性越强
B.原子核外的 M层上的 s能级和 p能级都填满了电子,而 d轨道上尚未排有电子的两种原子,其对应元素不一定位于同一周期
C.元素电负性越大的原子,失电子能力越强
D.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
查看答案和解析>>
科目:高中化学 来源: 题型:
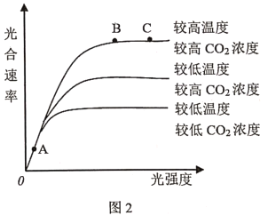
【题目】卡尔文循环过程如图1所示,探究各种环境因素对光合作用的综合影响结果如图2所示。请分析回答:
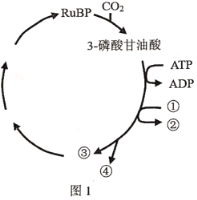
(1)图1过程在叶绿体的________中进行,RuBP的组成元素是________,![]() 和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
(2)图1中的物质①可以为3-磷酸甘油酸的还原提供________,每生成1分子物质④需要经过________轮卡尔文循环,此时有________分子物质③用于RuBP的再生。
(3)图2中的自变量为________,限制A点光合速率的主要因素是________;若由A点条件变为B点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小/基本不变);若由B点条件变为C点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小基本不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
(B中试剂为浓盐酸、碳酸钠溶液、硅酸钠溶液)
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:

注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是_____,主要作用是________。三颈瓶中发生反应的化学方程式为_______。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_________。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000 mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_______(保留一位小数)。下列情况会使测定结果偏低的是____(填字母)。
a.滴定终了俯视读取数据 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将指示剂换为甲基橙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
(1)蛋白质是人体必需的营养物质,它在人体内最终分解为_______
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号)。
富含维生素C的是________;可直接进入血液,补充能量的是_______ ;应用最广泛的抗生素之一的是_______;即可作为调味剂,又可作为防腐剂的是_______;食用过多会引起血压升高、肾脏受损的_________。
(3)鸡蛋含有丰富的蛋白质,它在人体内消化过程如下:
![]()
请回答下列问题:
a.向鸡蛋清溶液中滴入几滴浓硝酸,微热,鸡蛋清变为________色。
b.氨基酸具有两性,是因为氨基酸分子中既含有碱性官能团又含有酸性官能团,其中,碱性官能团是____________,酸性官能团是____________。
c.向鸡蛋清溶液中加入饱和Na2SO4溶液,有白色沉淀产生,发生的是_______(填“盐析”或“变性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com