(2010?卢湾区二模)高锰酸钾在不同的条件下发生还原反应如下:
MnO
4-+5e+8H
+→Mn
2++4H
2O
MnO
4-+3e+2H
2O→MnO
2↓+4OH
-MnO
4-+e→MnO
42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子还原产物受到溶液的
酸碱性
酸碱性
影响.
(2)将SO
2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
MnO4-
MnO4-
→
Mn2+
Mn2+
.
(3)将PbO
2投入到MnSO
4酸性溶液中搅拌溶液变为紫红色.下列说法正确的是
a
a
.
a.氧化性:PbO
2>KMnO
4 b.还原性:PbO
2>KMnO
4 c.该反应可以用盐酸酸化
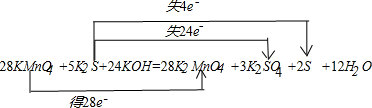
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K
2SO
4和S的物质的量比为3:2.完成下列化学方程式,并标出电子转移的方向和数目.
28
28
KMnO
4+
5
5
K
2S+
24KOH
24KOH
→
28
28
K
2MnO
4+
3
3
K
2SO
4+
2
2
S↓+
12H2O
12H2O
若生成5.44g单质硫,反应过程中转移的电子数约为
2.38NA
2.38NA
;若反应中有22mol电子转移,则生成K
2SO
4和S的物质的量比为
3:2
3:2
.

 ;2.38NA;3:2.
;2.38NA;3:2.
