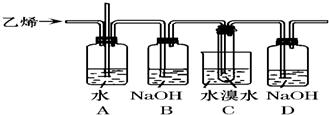
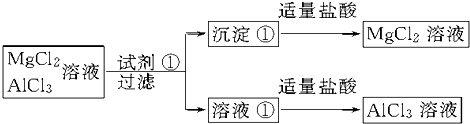
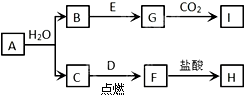
解答:
解:(1)电池的构成原理是自发进行的氧化还原化学反应在理论上可以设计成原电池
A.C(s)+C0
2(g)=2C0(g),是吸热反应,不能涉及成原电池,故A错误;
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H
20(1),是复分解反应,不是氧化还原反应,故B错误;
C.2H
20(l)=2H
2(g)+0
2(g),反应是非自发进行的氧化还原反应,故C错误;
D.2C0(g)+0
2(g)=2C0
2(g),反应是自发进行的氧化还原反应,故D正确;
一氧化碳燃料电池在熔融的K
2CO
3与CO
2为反应的环境中,传到离子为碳酸根离子,负极是一氧化碳失电子生成二氧化碳,电极反应为:CO-2e
-+CO
32-=2CO
2 ;
故答案为:D;CO-2e
-+CO
32-=2CO
2 ;
(2)①氮气和氢气合成氨气的反应是气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
A.反应是气体体积变化的反应,压强保持不变说明反应达到平衡,故A正确;
B.反应过程中气体质量不变,体积不变,反应过程中密度不变,气体密度保持不变,不能说明反应达到平衡,故B错误;
C.NH
3的生成速率是N
2的生成速率的2倍,说明正逆反应反应速率相同,反应达到平衡,故C正确;
故答案为:AC;
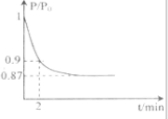
②2min时压强之比为P;Po=0.9,相同条件下气体物质的量之比等于压强之比,设反应后的气体物质的量为n,则P:Po=n:20=0.9,n=18mol,反应前后物质的量减小2mol,依据反应的过程分析,减少的物质的量为生成的氨气物质的量,氨气表示的反应速率=
=0.2mol/L?min,依据反应速率之比等于化学方程式系数之比得到氮气表示的反应速率为0.11mol?L
-1?min
-1;
故答案为:0.1mol?L
-1?min
-1;
③提高N
2的转化率可采取的措施是平衡正向进行
A.向体系中按体积比1:1再充入N
2和H2,恒温恒容容器中计入铜比例的起始量相当于增大压强,平衡正向进行,氮气的转化率增大,故A符合;
B.分离出NH
3,平衡正向进行,氮气的转化率增大,故B符合;
C.反应是吸热反应,升高温度平衡逆向进行,氮气的转化率减小,故C不符合;
D.充入He气使压强增大,恒温恒容容器中 气体分压不变,平衡不动,故D不符合;
E.加入一定量的N2,提高氢气的转化率,打不起的转化率减小,故E不符合;
故答案为:AB;
(3)某含有BaCO
3沉淀的悬浊液中,c(CO
32-)=0.2mol?L
-1,如果加入等体积的Na
2SO
4溶液,
此时c(CO
32-)=0.1mol?L
-1,则c(Ba
2+)=
mol/L=8×10
-8mol/L,
如溶液中生成沉淀,则应在混合液中满足c(Ba
2+)×c(SO
42-)>1×10
-10,c(SO
42-)>
mol/L=1.25×10
-3mol/L,
则加入Na
2SO
4溶液的物质的量浓度最小是2.5×10
-3mol/L.
故答案为:2.5×10
-3.



 阅读快车系列答案
阅读快车系列答案