
分析 由金属和非金属元素形成的化合物绝大多数为离子化合物(除了氯化铝和氯化铍),所有的铵盐均为离子化合物;
由非金属元素形成的化合物绝大多数为共价化合物(除了铵盐);
共价键分为极性共价键和非极性共价键,形成于同种原子间的为非极性键,形成于不同种原子间的为极性共价键,据此分析.
解答 解:A.O2是单质,不是离子化合物,两个氧原子间以非极性共价键结合;
B.冰是固态的水,是共价化合物,H原子和氧原子间以极性共价键结合;
C.氯化铵是离子化合物,铵根离子和氯离子间为离子键,而铵根离子中的N原子和H原子间为极性共价键;
D.NH3是共价化合物,N原子和H原子间为极性共价键;
E.烧碱即NaOH,为离子化合物,钠离子和氢氧根间为离子键,而氢氧根中的H原子和O原子间为极性共价键;
F.MgCl2为离子化合物,两个氯离子和镁离子之间均以离子键结合;
G.Na2O2 为离子化合物,钠离子和过氧根之间为离子键,而过氧根中的O原子之间为非极性共价键;
H.Ar为单原子分子,是单质,分子中无任何化学键.
故只含极性键的是BD;含非极性键的是AG;是离子化合物的是CEFG,
故答案为:BD;AG;CEFG.
点评 本题考查了极性键、非极性键的判断和离子化合物、共价化合物的判断,难度不大,根据物质的元素组成来分析即可,属于基础题型.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 苯(甲苯) | CCl4 | 分液 |
| C | 乙炔(硫化氢) | NaOH溶液 | 洗气 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ?CO2 | ||
| C. | CaCl2 ?NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑧ | B. | ③④⑤⑥ | C. | ②④⑤⑦⑧ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 稀HNO3和活泼金属反应时不能得到氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
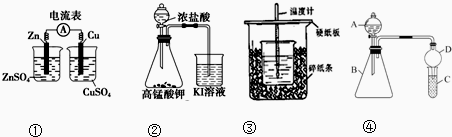
| A. | 装置①:检验电流的方向 | |
| B. | 装置②:探究氧化性:KMnO4>Cl2>I2 | |
| C. | 装置③:测定中和热 | |
| D. | 装置④:A、B、C中分别加入HCl、Na2CO3、Na2SiO3判断Cl、C、Si的非金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
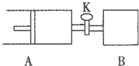 如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )| A. | 反应速率:v(B)>v(A) | |
| B. | A容器中X的转化率为80% | |
| C. | 平衡时的压强:PB=PA | |
| D. | 平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com