
【题目】如图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是

A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡Ⅰ后,增大反应物的浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种气体反应物在平衡态Ⅰ和平衡态Ⅱ时体积分数不相等
科目:高中化学 来源: 题型:
【题目】1892年比利时人索尔维以NaCl、CO2、NH3、H2O为原料制得了纯净的Na2CO3,该法又称氨碱法,其主要生产流程如下。完成下列填空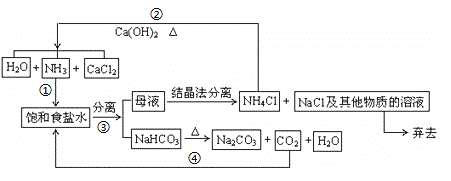
(1) 写出反应①中产生碳酸氢钠的离子方程式_________________________________。
(2)NaHCO3在水中溶解度较小,以沉淀形式析出,则图中③的操作名称___________________。从绿色化学原料的充分利用的角度看,该方法有明显的缺陷(答一条即可)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒![]() 与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥
与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥![]() 主要成分是Se,含有CuSe,
主要成分是Se,含有CuSe,![]() 等杂质
等杂质![]() 为原料,提炼硒的流程如下:
为原料,提炼硒的流程如下:
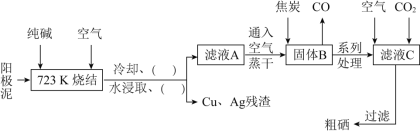
请回答下列问题:
![]() 硒原子的次外层电子数为________,与硒同周期相邻元素是________
硒原子的次外层电子数为________,与硒同周期相邻元素是________![]() 填元素名称
填元素名称![]() 。
。
![]() 已知滤液A中主要成分是
已知滤液A中主要成分是![]() ,可用于治疗克山病,则
,可用于治疗克山病,则![]() 的化学名称为________;滤液C中主要成分是
的化学名称为________;滤液C中主要成分是![]() ,则
,则![]() 的电子式为________。
的电子式为________。
![]() 上述流程图中的括号内“
上述流程图中的括号内“![]()
![]() ”,按操作先后顺序依次填写的内容是________、________。
”,按操作先后顺序依次填写的内容是________、________。
![]() 写出高温下用焦炭还原固体B的化学方程式________。
写出高温下用焦炭还原固体B的化学方程式________。
![]() 滤液C中析出硒的离子方程式为________。
滤液C中析出硒的离子方程式为________。
![]() 向
向![]() 溶液中滴加稍过量的乙酸,其离子方程式为________。已知:
溶液中滴加稍过量的乙酸,其离子方程式为________。已知:![]() 、
、![]() 、
、![]() 。
。
![]() 粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是________![]() 填标号
填标号![]() 。
。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
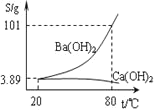
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。
![]() 生产制备:工业上一般以重晶石
生产制备:工业上一般以重晶石![]() 为原料,采用高温煅烧还原法;实验室一般以重晶石
为原料,采用高温煅烧还原法;实验室一般以重晶石![]() 为原料,采用沉淀转化法。
为原料,采用沉淀转化法。
高温煅烧还原法:
![]()
![]() 煅烧还原的化学方程式为:_____________。
煅烧还原的化学方程式为:_____________。
![]() 为了提高浸取速率,可采取的措施是__________
为了提高浸取速率,可采取的措施是__________![]() 任写一种
任写一种![]() 。
。
![]() 经检验BaS的水溶液呈碱性,原因是
经检验BaS的水溶液呈碱性,原因是![]() 用离子方程式表示
用离子方程式表示![]() __________。
__________。
沉淀转化法:向![]() 沉淀中加入饱和
沉淀中加入饱和![]() 溶液,充分搅拌,弃去上层清液。如此处理多次,直到
溶液,充分搅拌,弃去上层清液。如此处理多次,直到![]() 全部转化为
全部转化为![]() :
:![]() 平衡常数
平衡常数![]()
![]() 现有
现有![]() ,每次用
,每次用![]() 饱和
饱和![]() 溶液处理,假定
溶液处理,假定![]() 能全部转化,至少需要处理_____________次。
能全部转化,至少需要处理_____________次。
![]() 从“绿色化学”角度分析,用饱和
从“绿色化学”角度分析,用饱和![]() 溶液沉淀转化法的优点是:__________。
溶液沉淀转化法的优点是:__________。
![]() 分离提纯
分离提纯
某实验室分离提纯混有少量碳酸钙杂质的碳酸钡样品的步骤如下:
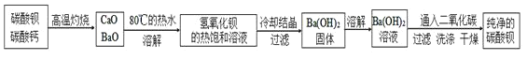
![]() 将灼烧后的固体混合物置于
将灼烧后的固体混合物置于![]() 的热水中,制成氢氧化钡的热饱和溶液。为减少
的热水中,制成氢氧化钡的热饱和溶液。为减少![]() 的损失并除去不溶物应进行的操作是_____。
的损失并除去不溶物应进行的操作是_____。
![]() 向制得的
向制得的![]() 溶液中滴加_______
溶液中滴加_______![]() 填一种试剂名称
填一种试剂名称![]() ,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
![]() 环境监测
环境监测
![]() 环境监测某工厂废水中
环境监测某工厂废水中![]() 的浓度。取废水
的浓度。取废水![]() ,控制适当的酸度加入足量的
,控制适当的酸度加入足量的![]() 溶液,得
溶液,得![]() 沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时
沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时![]() 全部转化为
全部转化为![]() ,再加入过量KI溶液,反应液中再滴加
,再加入过量KI溶液,反应液中再滴加![]() 溶液,反应完全时,消耗
溶液,反应完全时,消耗![]() 溶液
溶液![]() 。已知有关的离子方程式为:
。已知有关的离子方程式为:![]() ;
;![]() 。
。
该工厂废水中![]() 的物质的量浓度__________
的物质的量浓度__________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上为了处理含有Cr2O![]() 酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Fe(OH)3和Cr(OH)3沉淀生成,经处理后的工业废水中铬(Cr)的含量已低于排放标准。请回答下列问题:
酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Fe(OH)3和Cr(OH)3沉淀生成,经处理后的工业废水中铬(Cr)的含量已低于排放标准。请回答下列问题:
(1)电极反应式:阳极___,阴极___。
(2)写出Cr2O![]() 变为Cr3+的离子方程式___。
变为Cr3+的离子方程式___。
(3)工业废水pH升高的原因___。
(4)该装置中不能改用石墨电极,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为______(填“原电池”“电解池”或“电镀池”),通入CH3OH 电极的电极反应式为 _____________________________________。
(2)乙池 A(石墨)电极的名称为_________(填“正极”“负极”“阴极”或“阳极”),乙池中总反应式为 ____________________________________。
(3)当乙池中 B 极质量增加 5.40 g 时,甲池中理论上消耗 O2 的体积为_____________mL(标准状况下),丙池中___________极析出 ______ g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,丙中溶液的 pH 将_______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:
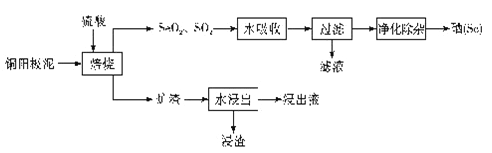
回答下列问题:
(1)“焙烧”时的硫酸浓度最好为_____(填标号)。
A.浓硫酸 B. 20%硫酸 C.50%硫酸 D. 80%硫酸
(2)“焙烧”过程中Cu2Se参与反应时,该反应的氧化产物是_______。
(3)“水吸收”所发生反应的化学方程式为____________。
(4)“过滤”所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
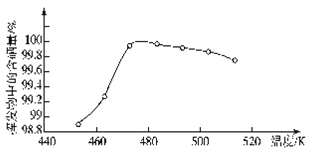
蒸馏操作中控制的最佳温度是_____(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
(5)“水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是____________________,“浸渣”中含有的金属单质是___________。
(6)若“浸出液”中,c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为___________________(已知:Ksp(Ag2SO4)=1.4×10-5,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
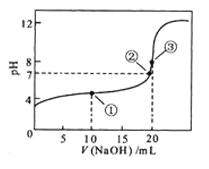
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com