
分析 (1)计算NO物质的量,再计算NO2、N2O4总物质的量,气体全部为NO、NO2时,得到硝酸最少,气体为NO、N2O4时得到硝酸最多,结合N原子守恒计算;
(2)根据c=$\frac{1000ρω}{M}$计算98%浓硫酸密度、87%硫酸的物质的量浓度,再根据稀释定律计算吸水后硫酸体积,进而吸收水的质量;
(3)根据蒸馏过程中硝酸、硝酸镁质量不变,表示出蒸馏后97.5%的HNO3的质量、60%的Mg(NO3)2溶液质量,蒸馏后溶液质量之和=原溶液质量之和-损耗水的质量;
(4)根据N原子守恒计算n(NaNO3),NO、NO2和NaOH溶液反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,结合方程式计算原混合气体中NO和NO2的物质的量,再根据氧原子守恒解答.
解答 解:(1)NO的物质的量为1.25mol×0.6=0.75mol,则NO2、N2O4总物质的量为1.25mol-0.75mol=0.5mol,
气体全部为NO、NO2时,得到硝酸最少,根据N原子守恒,得到硝酸极小值为1.25mol,
气体为NO、N2O4时得到硝酸最多,根据N原子守恒,得到硝酸极大值为0.75mol+0.5mol×2=1.75mol,
则:1.25mol<n(HNO3)<1.75mol,
故答案为:1.25mol<n(HNO3)<1.75mol;
(2)98%浓硫酸密度为$\frac{18.4×98}{1000×98%}$g/mL=1.84g/mL,
87%(密度1.8g/cm3)的硫酸物质的量浓度为$\frac{1000×1.8×87%}{98}$mol/L,
根据稀释定律,50mL浓硫酸吸水失去吸水能力后溶液体积为:$\frac{50mL×18.4mol/L}{\frac{1000×1.8×87%}{98}mol/L}$=57.57mL,
则吸收水的质量为:$\frac{50mL×18.4mol/L}{\frac{1000×1.8×87%}{98}mol/L}$×1.8g/mL-50mL×1.84g/mL=11.63g
故答案为:11.63;
(3)蒸馏后得到97.5%的HNO3的质量为$\frac{{m}_{1}×65%}{97.5%}$,得到60%的Mg(NO3)2溶液质量为$\frac{{m}_{2}×72%}{60%}$,损耗水的总质量为(m1+m2)×5%,则:
$\frac{{m}_{1}×65%}{97.5%}$+$\frac{{m}_{2}×72%}{60%}$=(m1+m2)-(m1+m2)×5%
整理可得:$\frac{{m}_{1}}{{m}_{2}}$=0.88
故答案为:0.88;
(4)根据N原子守恒得n(NaNO3)=n(NOx)-n(NaNO2)=0.5mol-0.35mol=0.15mol,
由 2NO2+2NaOH=NaNO2+NaNO3+H2O,可知生成0.15mol硝酸钠需要0.3molNO2,同时生成0.15mol亚硝酸钠,则反应NO+NO2+2NaOH=2NaNO2+H2O生成的亚硝酸钠为0.35mol-0.15mol=0.2mol,则该反应中消耗0.1molNO2、0.1molNO,所以原混合气体中NO、NO2的物质的量分别是0.1mol、0.4mol,尾气中NO与NO2的平均组成记为NOx,则x=$\frac{0.1mol×1+0.4mol×2}{0.5mol}$=1.8,
故答案为:1.8.
点评 本题考查混合物有关计算、溶液浓度计算,题目计算量大,属于易错题目,有利于培养学生的分析计算能力,注意极限法与守恒法的应用,难度中等.


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 在容量瓶中直接溶解氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4CBr4CsCl SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
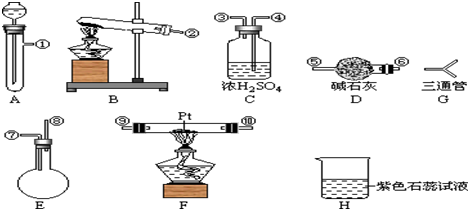
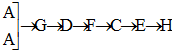 [按装置先后顺序排列]
[按装置先后顺序排列]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A B D C | B. | B A C D | ||
| C. | A B C D | D. | B A D C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中一定存在共价键;最外层有2个电子的原子都是金属原子 | |
| B. | 非极性键可以存在于离子化合物中; 质子数相同的粒子不一定属于同种元素 | |
| C. | 同位素的化学性质几乎完全相同;任何原子的原子核都是由质子和中子构成的 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构; 伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的冶炼原理,就是运用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来 | |
| B. | 有些活泼金属如铝可作热还原法的还原剂 | |
| C. | 用电解熔融NaCl的方法来冶炼金属钠 | |
| D. | 用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com