
分析 找出反应物中化合价升降的元素,化合价升高的元素所在物质前的系数定为化合价降低的元素降低的化合价数,化合价降低的元素所在的物质前的系数定为化合价升高的元素升高的化合价数,然后根据原子守恒依次配平即可.
解答 解:(1)Cu+HNO3(稀)══Cu(NO3)2+NO↑+H2O反应中:Cu由0→+2价,升高2价,NO中的氮元素由+5→+2价,降低3价;根据氧化还原反应化合价升降数目相等,所以Cu前配3,NO前配2(不在HNO3前写上2是因为有一部分的HNO3中的N没有改变化合价;即HNO3在这个反应里一部分充当酸,一部分充当氧化剂);根据元素守恒Cu(NO3)2前配3;计算右边的氮原子有8个,那就在左边的HNO3前配8;最后计算左边的氢原子,氢原子有8个,那么右边H2O前就写上4;故反应的化学方程式为3Cu+8 HNO3=3 Cu(NO3)2+2NO↑+4H2O,
故答案为:3、8、3、2、4;
(2)Cu+HNO3(浓)══Cu(NO3)2+NO2↑+H2O反应中:Cu由0→+2价,升高2价,NO2中的氮元素由+5→+4价,降低1价;根据氧化还原反应化合价升降数目相等,所以Cu前配1,NO2前配2(不在HNO3前写上2是因为有一部分的HNO3中的N没有改变化合价;即HNO3在这个反应里一部分充当酸,一部分充当氧化剂);根据元素守恒Cu(NO3)2前配1;计算右边的氮原子有4个,那就在左边的HNO3前配4;最后计算左边的氢原子,氢原子有4个,那么右边H2O前就写上2;故反应的化学方程式为1Cu+4 HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O,故答案为:1、4、1、2、2;
(3)Na+H2O═NaOH+H2↑反应中:Na由0→+1升高1价,氢气中H由+1→0降1价一个H2中有2个H变化生成一个氢分子降2价,根据化合价升降相等,Na前面配2,H2前配1,根据Na元素守恒,NaOH前配2,根据H元素守恒H2O前配2,故反应方程式为2Na+2H2O═2NaOH+1H2↑,故答案为:2、2、2、1.
点评 本题难度较大,掌握利用氧化还原反应得失电子守恒进行配平的方法并能灵活运用不同的方法进行配平,如部分氧化还原反应的配平是正确解答本题的关键.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁是人体健康、植树生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 | |
| B. | 在采煤作业中,把炸药和干冰放在一起,既能增强爆炸威力,又能防止火灾 | |
| C. | 氢氧燃料电池已用于航天飞机,燃料电池的能量转化率理论上可达100% | |
| D. | 聚乙烯塑料可用于制作餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
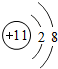 ;
;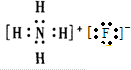 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com