
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
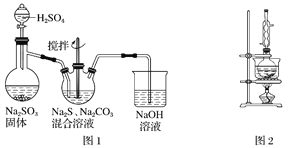
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是________________________。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除生成Na2S2O3外,还有________(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:_______________________________________________________________________。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加________作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有________。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤如下,请填写实验操作。
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示组装所需仪器,向冷凝管中通入冷却水,水浴加热;
③待________________时,停止加热,将烧瓶取下;
④____________________________________________________________________;
⑤____________________________________________________________________;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
【答案】 吸收SO2等尾气,防止污染空气 NaCl IO+5I-+6H+===3I2+3H2O 淀粉溶液 酸式滴定管 偏低 烧瓶中固体不再减少 趁热过滤 将所得滤液冷却结晶,过滤
【解析】试题分析:(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是吸收多余的二氧化硫气体,防止污染空气;如将分液漏斗中的H2SO4改成浓盐酸,因为浓盐酸易挥发,HCl与反应物反应生成NaCl,则三颈烧瓶内除Na2S2O3生成外,还有NaCl生成;
(2)①利用KIO3、KI和HCl可配制标准碘溶液,碘酸根离子与碘离子在酸性条件下发生歧化反应生成碘单质,离子方程式是IO3-+5I-+6H+===3I2+3H2O;
②用标准碘溶液进行滴定Na2S2O3溶液,所以应用淀粉作指示剂,溶液变蓝色,说明达到滴定终点;因为碘具有氧化性,所以标准碘溶液应用酸式滴定管盛放,则滴定时所用的玻璃仪器除锥形瓶外,还有酸式滴定管;
③ 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,此时并未达到滴定终点,消耗碘溶液的体积偏少,造成样品中Na2S2O3·5H2O的质量分数偏低;
(3)③因为硫化钠中的杂质不溶于酒精,所以等到烧瓶中固体不再减少时,说明硫化钠全部溶液酒精;
④ 因为硫化钠在酒精中的溶解度随温度升高而增大,若温度降低,则会有部分硫化钠固体析出,所以此时应趁热过滤,除去杂质;
⑤ 上步中得到的滤液主要是硫化钠的酒精溶液,因为温度降低,硫化钠的溶解度减小,所以将所得滤液冷却结晶,过滤,可得到硫化钠晶体。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】下列关于自然界中碳循环(如图)的说法中,不正确的是( ) 
A.呼吸作用涉及氧化还原反应
B.碳循环具有全球性
C.含碳化合物可相互转化
D.碳元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对人类的生存发展具有重要意义,科学家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一种固氮酶,能在常温下将空气中的氮气转化为自身生长所需的含氮化合物,下列说法错误的是____(填标号)。
a.固氮酶是一种蛋白质
b.固氮酶能降低固氮反应发生所需的能量
c.固氮酶能使固氮反应的平衡正向移动
d.固氮酶能加快固氮反应的速率
(2)合成氨是目前最重要的固氮方法。下图为合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
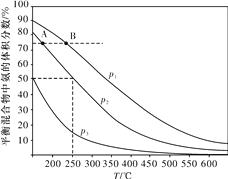
①A、B两平衡状态相比较,前者较大的是____(填标号)。
a.平衡常数
b.平衡混合物的平均摩尔质量
c.氢气的转化率
d.从反应开始至达到平衡状态所需要的时间
②图中p1、p2、p3由大到小的顺序为____。
③在250 ℃、p2下,H2的转化率为____%(结果保留小数点后一位)。
(3)据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和一种单质。已知:
①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.2 kJ/mol
2NH3(g) ΔH2=-92.2 kJ/mol
写出此条件下氮气和水反应的热化学方程式:___。
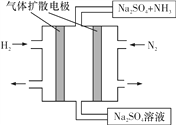
(4)下图为一种常温常压下水溶液中电化学合成氨的实验装置示意图。请据此写出其正极反应的电极反应式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是4种前三周期元素,且原子序数逐渐增大,这四种元素的基态原子的未成对电子数和电子层数相等。请回答下列问题:
(1)D元素的基态原子价电子排布式是:____________________________________;
(2)A、B、C三种元素可以形成化合物A4B2C2,它是厨房调味品之一。1 mol A4B2C2中含有________molσ键,其中B原子采用的杂化方式为:_____________;
(3)元素F的原子序数是介于B和C之间的,元素B、C、F的电负性的大小顺序是: _______________B、C、F的第一电离能的大小顺序是____________(由大到小,用元素符号填空);
(4)随着科学的发展和大型实验装置(如同步辐射和中子源)的建成,高压技术在物质研究中发挥越来越重要的作用。高压不仅会引发物质的相变,也会导致新类型化学键的形成。近年来就有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl 晶体在50~300GPa 的高压下和Na 或Cl2反应,可以形成不同组成、不同结构的晶体。下图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子)。写出A、B、C 的化学式。A:_______________; B:__________________; C:___________________

(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。合成磷化硼的化学反应方程式:BBr3+PBr3+3H2=BP+6HBr
①分别画出三溴化硼分子和三溴化磷分子的结构。_____________、_________________

磷化硼晶体中磷原子作面心立方最密堆积,硼原子填入部分四面体空隙中。磷化硼的晶胞示意图如下:

②已知磷化硼的晶胞参数a = 478 pm,计算晶体中硼原子和磷原子的核间距(dB-P)(写出计算式,不要求计算结果)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质X和Y相互反应生成X2+和Y2-,现有下列叙述其中正确的是( )
①X被氧化 ②X是氧化剂 ③X具有氧化性
④Y2-是还原产物 ⑤Y2-具有还原性 ⑥X2+具有氧化性
A.①②③④B.①④⑤⑥C.②③④D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. ①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式: . 
②已知:
化学键 | H﹣H | N≡N |
键能(kJ/mol) | 435 | 943 |
试根据上表及图1中的数据计算N﹣H键的键能为kJ/mol.
③若起始时向容器内放入1mol N2和3mol H2 , 10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知: CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=﹣53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)CH3OCH3 (g)+3H2O(g)△H3=kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是a~m九种元素在周期表中的位置,请回答下列问题:
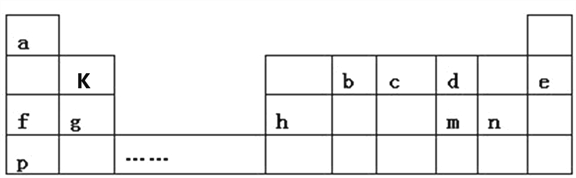
(1)m的阴离子结构示意图为____________。
(2)b的最高价氧化物的电子式为____________;用电子式表示f2 d2的形成过程_______________________。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___________(用离子符号填写)。
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为__________(填化学式)。
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为___________。
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为__________。
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为________________________。
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。

①丁属于_____________(选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com