
| A. | 在CH2=CH2分子中,存在五个s-sp2σ键和一个π键 | |
| B. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| C. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 | |
| D. | 在共价化合物中,一定存在极性共价键,可能存在非极性共价键,一定不存在离子键 |
分析 A.C=C中含有1个sp2-sp2σ键和1个π键;
B.同周期,随原子序数增大,电负性增强,第一电离能增大,但N原子的2p电子半满为稳定结构;
C.元素的非金属性越强,对应最高价氧化物的水化物的酸性越强;晶体熔点较高容易在岩浆冷却过程中先结晶;
D.同种非元素之间形成非极性键,不同种非元素之间形成极性键.
解答 解:A.在CH2=CH2分子中,含有4个C-H键为s-sp2σ键、C=C中含有一个sp2-sp2σ键和一个π键,故A错误;
B.同周期,随原子序数增大,电负性增强,则电负性:F>O>N,第一电离能增大,但N原子的2p电子半满为稳定结构,则第一电离能F>N>O,故B错误;
C.元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,H2SO3和H2SeO3不是最高价氧化物的水化物,不能确定其酸性强弱;晶体熔点较高容易在岩浆冷却过程中先结晶,则岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3,故C错误;
D.共价键化合物是由不同元素构成的只含有共价键,一定存在极性共价键,可能存在非极性共价键,如H2O2,故D正确.
故选D.
点评 本题考查了化学键、元素性质的比较,把握非金属性与电负性、第一电离能的关系,侧重规律性知识的考查,注意元素周期表和周期律的应用,题目难度不大


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
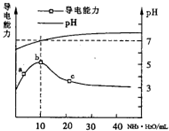 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)×c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 无论乙烯与丙烯酸以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值 | |
| B. | 鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用KMnO4溶液、溴水 | |
| C. | 苯中的少量苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| D. | 苯酚的酸性很弱,但可以和Na2CO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
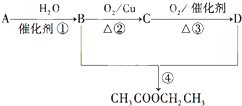 已知:
已知: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
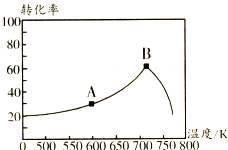 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com