
【题目】下列变化过程中,△S<0的是( )
A.氯化钠溶于水
B.NH3(g)与HCl(g)反应生成NH4Cl(s)
C.干冰升华
D.煅烧石灰石
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从冬青中提取出的有机物A可用合合成抗结肠炎药物Y及其他化学品,合成路线如图:
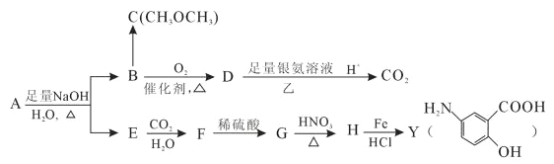
根据上述信息回答:
(1)请写出Y中含氧官能团的名称_________________________。
(2)写出反应③的反应类型:________________________________。
(3)写出反应①的化学方程式:_______________________________________。
(4)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成![]() 和
和![]() ,鉴别I和J的试剂为____________________。
,鉴别I和J的试剂为____________________。
(5)G的同分异构体中,满足下列条件的有_____________种。
①能发生银镜反应 ②能与氯化铁溶液发生显色反应
其中核磁共振氢谱显示四种不同类型的吸收峰。且其峰面积之比为1:2:2:1的结构简 式为____(写一种)。
(6)A的另一种同分异构体K用于合成高分子材料M(![]() ),K 可由L(
),K 可由L(![]() )制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:
)制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:![]() ___________________________
___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是( ) 
A.A是反应物
B.前2 min A的分解速率为0.1 molL﹣1min﹣1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 盐酸 | 醋酸 | 碳酸 | 氨水 | 氯水 |
B | 纯碱 | 碘酒 | 苛性钾 | 冰醋酸 | 干冰 |
C | 石油 | 石灰石 | 硫酸 | 磷酸 | 水 |
D | 烧碱 | 天然气 | 氯化钠 | 碳酸钠 | 蔗糖 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
【答案】 二 ⅥA 5 弱 硫原子半径大于氧原子半径,硫原子和氧原子的最外层电子数相等,硫原子的得电子能力比氧原子弱 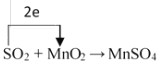 在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
【解析】试题分析:(1)氧原子核外有2个电子层,最外层有6个电子,硫原子核外电子排布式是1S22S22P63S23P4;(2)同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,锰元素化合价由+4降低为+2;(4)氧气能把二氧化硫氧化为 H2SO4;二氧化硫污染空气,用氢氧化钙能吸收二氧化硫;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,根据化合价升降相同计算物质的量之比。
解析:(1)氧原子核外有2个电子层,最外层有6个电子,所以氧元素在元素周期表中位于第二周期ⅥA族,硫原子核外电子排布式是1S22S22P63S23P4,有5个能级,所以有5种能量不同的电子;(2) 同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,所以S非金属性比O弱;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,硫失去2个电子,锰元素化合价由+4降低为+2,锰元素得到2个电子,所以电子转移方向和数目是 ;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
点睛:氧化还原反应中,氧化剂得电子化合价降低,还原剂失电子化合价升高,根据氧化还原反应的升降规律,氧化剂得电子数一定等于还原剂失电子数。
【题型】综合题
【结束】
22
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:
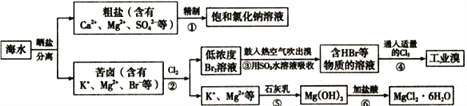
(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:
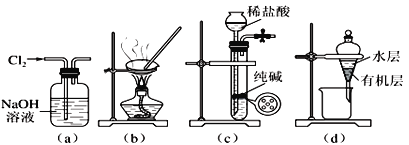
A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH为13的Ba(OH)2、NaOH的混合液100mL,从中取出24mL.用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.求:①当滴到沉淀不再增加时(溶液体积变化忽略不计),溶液的pH=________(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=________和c(NaOH)=________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com