
| A. | Al2O3 | B. | Fe2O3 | C. | CO2 | D. | SiO2 |
分析 Al、Al2O3、Al(OH)3、弱酸的酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质都能和强酸、强碱反应,据此分析解答.
解答 解:A.Al2O3属于两性氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,故A正确;
B.Fe2O3属于碱性氧化物,能和稀盐酸反应生成盐和水,和碱不反应,故B错误;
C.二氧化碳属于酸性氧化物,能和NaOH溶液反应生成盐和水,故C错误;
D.二氧化硅属于酸性氧化物,和稀盐酸不反应,能和NaOH反应生成盐和水,故D错误;
故选A.
点评 本题考查两性氢氧化物、两性氧化物等知识点,侧重考查元素化合物知识,熟悉常见元素化合物知识,总结归纳并灵活运用,注意氢氧化铝不溶于弱碱,题目难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
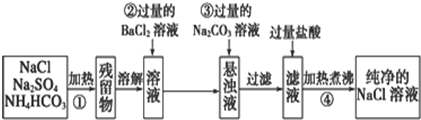
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如下图1所示,为六方最密堆积(填堆积方式).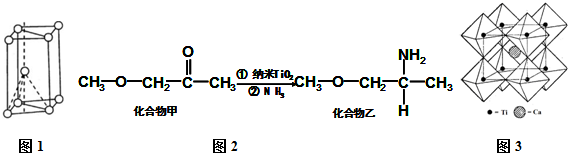
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
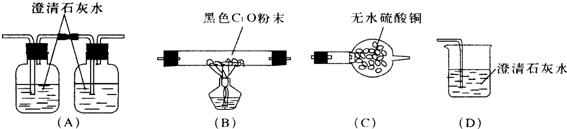
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
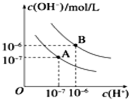 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验①所涉及的物质均为电解质 | |
| B. | 实验②、③得到的分散系中分散质粒子的直径:②>③ | |
| C. | 实验③得到的物质能产生丁达尔现象 | |
| D. | 实验③反应制得的物质为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
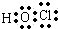 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com