【答案】
分析:(1)根据Cu的电子排布式书写Cu
2+离子的电子排布式;
(2)利用均摊法分析晶胞的结构;
(3)根据结构示意图中所有氧原子都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析;
(4)根据电负性的角度分析;
(5)从影响离子晶体熔沸点高低的角度分析.
解答:解:(1)Cu(电子排布式为:[Ar]3d
104s
1)Cu
2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu
2+离子的电子排布式是为:[Ar]3d
9或1s
22s
22p
63s
23p
63d
9,故答案为:[Ar]3d
9或1s
22s
22p
63s
23p
63d
9;
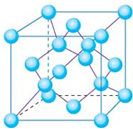
(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:

=4,故答案为:4;
(3)A.在上述结构示意图中,所有氧原子都是饱和氧原子,所以都采用sp
3杂化,故A正确;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确.
故答案为:ABD.
(4)N、F、H三种元素的电负性:F>N>H,所以NH
3中共用电子对偏向N,而在NF
3中,共用电子对偏向F,偏离N原子,故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF
3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF
3不易与Cu
2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF
3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu
2+形成配位键.);
(5)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu
2O的熔点比Cu
2S的高.
故答案为:高;Cu
2O与Cu
2S相比,阳离子相同、阴离子所带的电荷数也相同,但O
2-半径比S
2-半径小,所以Cu
2O的晶格能更大,熔点更高.
点评:本题考查常见元素核外电子排布、电负性概念、常见轨道杂化类型、以及离子晶体的晶胞结构、化学键、物质性质、配合物成键状况的了解,题目难度中等,学习中注意加强对晶胞以及晶体结构的分析.



 =4,故答案为:4;
=4,故答案为:4;

 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.