
| A. | 钠、镁、铝 | B. | 钠、钾、铷 | C. | 银、汞、铜 | D. | 铁、镁、钠 |
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO含有的分子数为0.5NA | |
| B. | 标准状况下,22.4LSO3含有的分子数为NA | |
| C. | 常温常压下,8gO2含有的氧原子数为0.5NA | |
| D. | 同温同压下,11.2LCO和11.2LCO2含有的分子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
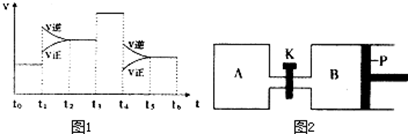
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
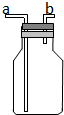 如图所示的装置在实验室种用途比较广泛.
如图所示的装置在实验室种用途比较广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NH4+含有的电子数为1.1NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O存在于乙酸乙酯中 | |
| B. | 生成的乙酸乙酯的相对分子质量为88 | |
| C. | 18O既存在于乙酸乙酯中,又存在于水中 | |
| D. | 18O存在于水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com