
| A. | $\frac{a}{V}$mol/L | B. | $\frac{b}{V}$ mol/L | ||
| C. | $\frac{a-2b}{V}$ mol/L | D. | $\frac{a-b}{V}$mol/L |
分析 amol NaOH刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知溶液中含有amolNH4+,
与氯化钡溶液完全反应消耗b molBaCl2,根据Ba2++SO42-═BaSO4↓可知溶液含有bmol SO42-,根据溶液不显电性,计算出溶液中NO3-的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:a mol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知,溶液中含有a molNH4+,
与氯化钡溶液完全反应消耗b mol BaCl2,根据Ba2++SO42-═BaSO4↓可知溶液中含有b mol SO42-,
设溶液中NO3-的物质的量为n,根据溶液不显电性,则:
a mol×1=b mol×2+n×1
解得:n=(a-2b)mol
溶液中c(NH4NO3)=c(NO3-)=$\frac{(a-2b)mol}{VL}$=$\frac{a-2b}{V}$mol/L,
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握电荷守恒在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | 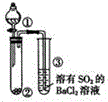 |
| A | 浓氨水 | CaO | |
| B | 浓硝酸 | Cu | |
| C | 浓盐酸 | KMnO4 | |
| D | 浓硫酸 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
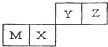
| A. | M元素一定为金属元素 | |
| B. | X元素的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 | |
| D. | Z元素与氢元素能形成原子个数比为1:1的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
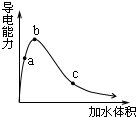 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )| A. | a、b、c三点醋酸的电离程度:c<a<b | |
| B. | a、b、c三点醋酸电离平衡常数:c<a<b | |
| C. | a、b、c三点溶液中的CH+:c<a<b | |
| D. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
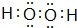 .固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.
.固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com