
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ�ƿ��ǩ�ϵIJ������ݣ����ø�Ũ��������500mLŨ��Ϊ1molL��1��ϡ���ᣮ�ɹ�ѡ�õ������У� 
�ٲ����� ���ձ� ��������ƽ ����Ͳ ��ҩ�� ��ͷ�ι� ��500mL����ƿ ��ϸ���Լ�ƿ
��ش��������⣺
��1������500mLŨ��Ϊ1molL��1��ϡ���ᣬ������Ͳ��ȡ ����Ũ�������ΪmL��
��2������ʱ��һ��ɷ�Ϊ���¼������裺����ȡ �ڼ��� ��ϡ�� ��ҡ�� ��ת�� ��ϴ�� �߶��� ����ȴ������ȷ�IJ���˳��Ϊ �� ����������������ѡȡ
����Ҫ�������� ��
��3��ʵ���������õ���������������ֱ� �� ��
��4�������ƹ����У����в���������������ҺŨ��ƫ����������ţ�
A.ϴ����ȡŨ�������Ͳ������ϴ��Һת�Ƶ�����ƿ��
B.δ��ϡ�ͺ��������Һ��ȴ�����¾�ת�Ƶ�����ƿ��
C.ת��ǰ������ƿ�к�����������ˮ
D.δϴ��ϡ��Ũ����ʱ�ù����ձ��Ͳ�����
E.����ʱ�����ӿ̶���
F.����ʱ��ˮ�����˿̶��ߣ������ý�ͷ�ι���ȥ�����ˮ��
���𰸡�
��1��27.2
��2���ڢ٢ۢ�ݢޢߢܣ��٢ڢܢޢߢ�
��3�����裻����
��4��ABE
���������⣺��1���ܶ�Ϊ1.84g/mL����������Ϊ98%��Ũ���ᣬ���ʵ���Ũ��C= ![]() =18.4mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ����������ã�18.4mol/L��V=1molL��1��500mL�����V=27.2mL��
=18.4mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ����������ã�18.4mol/L��V=1molL��1��500mL�����V=27.2mL��
���Դ��ǣ�27.2����2����Ũ��������ϡ�����һ���������Ϊ�����㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ�������ȷ�IJ�������Ϊ���ڢ٢ۢ�ݢޢߢܣ��õ�����������Ͳ����ͷ�ιܡ��ձ�����������500mL����ƿ��
���Դ��ǣ��ڢ٢ۢ�ݢޢߢܣ��٢ڢܢޢߢࣻ��3��ϡ��Ũ�����ò��������裬��Һʱ�ò�����������
���Դ��ǣ����裬��������4��A��ϴ����ȡŨ�������Ͳ������ϴ��Һת�Ƶ�����ƿ�У�������ȡ��Ũ�������ƫ���������ʵ���ƫ����ҺŨ��ƫ�ߣ���Aѡ��
B��δ��ϡ�ͺ��������Һ��ȴ�����¾�ת�Ƶ�����ƿ�У���ȴ����Һ���ƫС����ҺŨ��ƫ�ߣ���Bѡ��
C��ת��ǰ������ƿ�к�����������ˮ�������ʵ����ʵ�������Һ�����������Ӱ�죬��ҺŨ�Ȳ��䣬��C��ѡ��
D��δϴ��ϡ��Ũ����ʱ�ù����ձ��Ͳ��������������ʲ�����ģ����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���D��ѡ��
E������ʱ�����ӿ̶��ߣ�������Һ���ƫС����ҺŨ��ƫ�ߣ���Eѡ��
F������ʱ��ˮ�����˿̶��ߣ������ý�ͷ�ι���ȥ�����ˮ�����²���������ģ����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ���F��ѡ��
��ѡ��ABE��
�����㾫�������ڱ��⿼�������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�˽��������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶��߲��ܵó���ȷ�𰸣�


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���⡢������Ԫ����ɵ�TMB��һ������ָ�Ƽ���ɫԭ�Լ�������Է�������Ϊ240��ij�о���ѧϰС���ͬѧ����������װ�òⶨTMB�ķ���ʽ��ʵ��ԭ�����������������н�4.80gTMB��Ʒ��������Ԫ��ת��ΪN2�������������ռ��ֱ�����ˮ������CO2 �� ���ͼ��ѡ���ʵ���װ�ã�����װ�ÿ����ظ�������ʵ�飮 
��1������a������Ϊ ��
��2��ʵ��װ���������ӵ�˳��Ϊ ��
��3��д��װ��C�з�Ӧ�Ļ�ѧ����ʽ�� ��
��4����ʵ�������Ҫ������Ҫ����β�������������� ��
��5��ʵ���Ƶ�װ��A����������14.08g��װ��B����������3.60g���ռ���0.56g����������ÿ�����վ�����ȫ�ģ�����TMB�ķ���ʽΪ ��
��6�����ʵ����֤CO2���������ԣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�����ڱ��������в���ȷ����(����)
A. Ԫ�������������ǵڢ���
B. �ڢ�A�����Ԫ�ص��ʾ�����ˮ��Ӧ
C. �ڢ�A�����ǽ���Ԫ��
D. ����Ԫ�ص�����ȷǽ���Ԫ�ض�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ������в�ͬ�Ļ�ѧ����ͼ��ʾ�����Ҵ��ڸ��ַ�Ӧ��Ӧ���ѵļ�˵������ȷ���ǣ� �� 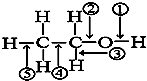
A.�ͽ���������ʱ�����ٶ���
B.��Ũ���Ṳ����170��ʱ�����ں͢ݶ���
C.�����ᡢŨ���Ṳ��ʱ�����ڶ���
D.�������º�������Ӧʱ�����ٺ͢۶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�����������������������NaCl��Һ����ʼԼ20���������������ɫ���ǣ�Ȼ��ʼ���ֻ���ɫ���ǣ�������ɽ϶�ĺ��ɫ����������˵����ȷ���ǣ� �� 
A.�����缫��Ӧʽ��Fe��3e���TFe3+
B.ˮ������������ɫ������ΪNaCl����
C.����ɫ������Fe��OH��2
D.���ŵ��Ľ��У���Һ�������Ա�ɼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ԭ�Ӷ����������Ϊ8���ӽṹ����
A. BF3B. H2SC. CCl4D. PCl5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ�������ж���ȷ���ǣ�������
A.18 g H2O���е���ԭ����ĿΪNA
B.��״���£�22.4LCO2���еķ�����ĿΪNA
C.1molL��1K2SO4��Һ�к��еļ�������ĿΪ2NA
D.1mol H2��O2����ȫȼ��ת�Ƶĵ�����ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڹ���Ԫ��Fe��Ti����C��H��N��O�γɶ��ֻ����
��1����H��C��N��O����Ԫ�صĵ縺����С�����˳��Ϊ ��
��������������ȷ���� �� ������ĸ��
a����ΪHCHO��ˮ���Ӽ����γ����������HCHO������ˮ
b��HCHO��CO2�����е�����ԭ�Ӿ�����sp2�ӻ�
c��C6H6�����к���6���Ҽ���1����м���C2H2�ǷǼ��Է���
d��CO2������۵㡢�е㶼�ȶ������辧��ĵ�
�����ᣨHOCN����һ����״���ӣ����������ᣨHNCO����Ϊͬ���칹�壬������ڸ�ԭ���������Ѵﵽ�ȶ��ṹ����д������Ľṹʽ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
����Feԭ�ӻ������γ������ķ��ӻ�����Ӧ�߱��Ľṹ������
���������������[Fe��CN��6]4������� ��
A�����ۼ� B���Ǽ��Լ� C����λ�� D���Ҽ� E���м�
д��һ���� CN����Ϊ�ȵ�����ĵ��ʷ���ʽ ��
��3������Ԫ��ԭ�ӵ���Χ�����Ų��������ɽ����ڱ��ֳ������������Ti��������
��4��һ��Al��Fe�Ͻ�����徧����ͼ��ʾ����ݴ˻ش��������⣺ 
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶ�=�� g/cm3 �� ��˺Ͻ������������Feԭ��֮��ľ��� ���ú��ѵĴ���ʽ��ʾ�����ػ���Ϊcm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ������ʱ���ɹ۲쵽�����ЧӦ������������(����)
A. ���� B. ��Һ
C. ����Һ D. ����Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com