
2SO2(g)+O2(g)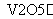 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=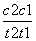
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,4 gCH4含有NA个C-H共价键
B. 1 mol Fe与足量稀HNO3反应,转移2NA个电子
C.1 L 0. 1 mol/L NaHCO3溶液中含有0. 1NA个HCO3-
D.常温常压下,22.4 LNO2和CO2的混合气体中含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
如图
 (1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL。
(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL。
(2)图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(25-a)mL
C.一定大于a mL D.一定大于(25-a)mL
(3)写出下列物质的水解离子方程式
NaClO溶液: Fe2 (SO4)3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O22SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反
应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
A.0.1 s B.2.5 s C.5 s D.10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
(I)在一定条件下,发生反应:
 aA(g) +bB(g) cC(g) △H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:
aA(g) +bB(g) cC(g) △H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:

依据图表判断该反应△H 0(填“>”或“<”):若其它条件保持一定,降低温度,该反应物A的转
化率 (填“增大”、“减小”或“不变”下同),化学反应速率将 。
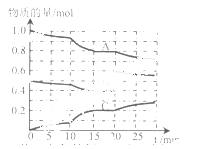
 (II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g) +bB(g) cC(g),容器中A、B、C物质的量
(II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g) +bB(g) cC(g),容器中A、B、C物质的量
变化如图所示,回答下列问题:
该化学方程式中a:b:c为 ,t℃时该反应的化学平衡常数K的值为____ 。(保留2位小数)
(2) 0~15 min内,B的平均反应速率为 ,反应达平衡时,A的转化率为 。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达),反应重新达平衡时,A的体积分数将 (填“增大”、“减小”或“不变”)。
(4) 10 min到15 min的曲线变化的原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
 (1)O3将I-氧化成I2的过程由3步反应组成:
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)==IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq) I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
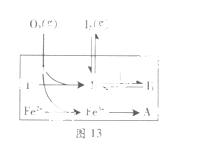
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
|
| 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+ I- | 5.2 | 11.0 |
| 第2组 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为 。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将V L  A气体(摩尔质量是M g/mol)溶于0.1 L水中,所得溶液的密度为d g/cm3,则此溶液的物质的量浓度为 ( )
A气体(摩尔质量是M g/mol)溶于0.1 L水中,所得溶液的密度为d g/cm3,则此溶液的物质的量浓度为 ( )
A.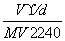 B.
B.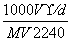
C.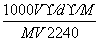
 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪些量为已知条件时,可用于求物 质的量浓度?先找出有关组合(填代号),再写出由这些量求物质的量浓度的计算式(每种情
质的量浓度?先找出有关组合(填代号),再写出由这些量求物质的量浓度的计算式(每种情 况最多只能选择三个量)。
况最多只能选择三个量)。
①溶液体积V(L) ②溶液的密度d(g·mL-1) ③溶质的摩尔质量M(g·mol-1)
④溶质的质量分数w ⑤溶质的质量m(g) ⑥气态溶质在标准状况下的体积V′(L)
第一种情况:已知________,则c=________mol·L-1;
第二种情况:已知________,则c=________mol·L-1;
第三种情况:已知________,则c=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,
2NO2(g)体系中, n(NO)随时间的变化如表:
n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________.已知:K300℃>K350℃,则该反应是________热反应.
(2)图中表示NO2的变化的曲线是________.用O2表示从0~2 s内该反应的平均速率v=________.

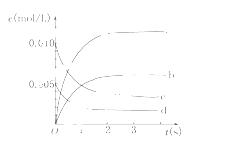
(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com