
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
分析 ①依据同主族元素从上到下金属性依次增强解答;
②金属性越强,阳离子氧化性越弱;
③活泼金属在自然界中只能够以化合态存在;
④碱金属从上到下密度逐渐增大,熔点依次减弱;
⑤依据同主族元素从上到下金属性依次增强,结合钠、钾与水反应现象解答;
⑥锂只有Li2O;
⑦依据原子半径大小比较规律:电子层越多半径越大解答.
解答 解:①.Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以金属性最强的是铯,故①正确;
②.Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以金属性最弱的是锂,所以氧化性最强的是锂离子,故②正确;
③碱金属单质性质活泼,容易与空气中水、氧气反应,所以在自然界中均以化合态形式存在,故③正确;
④碱金属从上到下密度逐渐增大,熔点依次减弱,Li的密度最小,熔点最高,故④正确;
⑤Li、Na、K、Rb、Cs属于碱金属元素从上到下金属性依次增强,所以铯金属性强于钠和钾,与水反应剧烈程度强于钠和钾,故⑤正确;
⑥锂只有Li2O,不含有过氧化物,故⑥错误;
⑦电子层不同的,一般电子层越大半径越大,所以Rb+、K+、Na+,电子层依次减少,所以半径Rb+>K+>Na+;Cs、Cs+,电子层依次减少,所以半径Cs>Cs+,故⑦正确;
故选:D.
点评 本题考查了碱金属的性质,侧重考查学生对基础知识掌握熟练程度,掌握同主族元素性质的递变规律即可解答,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 颜色褪成无色 | B. | 浅绿色逐渐加深 | C. | 没有变化 | D. | 变为棕黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
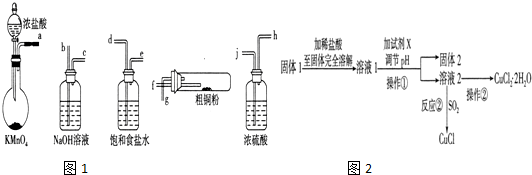
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
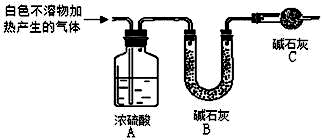
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA | |
| D. | 14g乙烯和丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
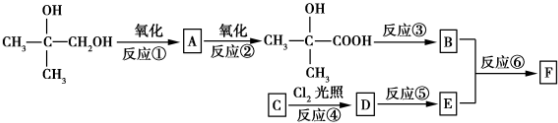
 .
.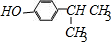 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
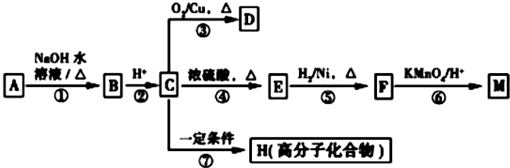
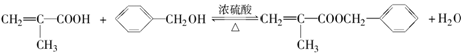
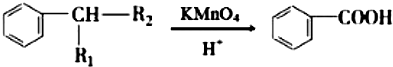 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)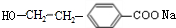 .
.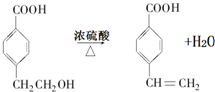 .
.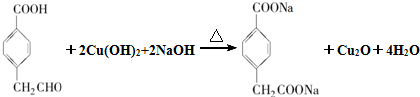 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com