
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
(主要成分)糖衣、碳酸镁、氢氧化铝、淀粉 | |
(性状)本品为糖衣,除去糖衣后显淡绿色 | (适应症)能缓解胃酸过多 |
(鉴别)取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | (用法用量)成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
(详细用法)详见说明书 |
I、根据“硫酸亚铁片”标签回答问题:
(1)硫酸亚铁片溶于水后溶液的颜色是_______________。
(2)硫酸盐中检验![]() 的离子反应方程式是______________________________________。
的离子反应方程式是______________________________________。
(3)鉴别中,“加稀盐酸1滴”的作用是__________________________________________。
(4)检验硫酸亚铁片是否被氧化的方法是________________________________________。
II、根据“氢氧化铝片”标签回答问题:
(1)能缓解胃酸过多的成分是__________________________________________。
(2)氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的______________。
A. 酸性 B. 碱性 C. 两性 D. 氧化性
(3)写出氢氧化铝的电离方程式:_____________________________________________。
【答案】淡绿色 SO42+Ba2+=BaSO4↓ 抑制Fe2+水解 取适量硫酸亚铁片,溶于水中配成溶液。取少量溶液,滴加数滴KSCN溶液,观察颜色变化。若无明显现象,说明硫酸亚铁片未被氧化 碳酸镁、氢氧化铝 B ![]()
![]()
![]()
【解析】
I (1)亚铁离子在溶液中呈浅绿色;
(2)硫酸根离子的检验:向溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生;
(3)亚铁离子在水溶液中易发生水解;
(4)硫酸亚铁中的亚铁离子具有较强还原性,容易被氧化成铁离子,可以通过加入硫氰化钾溶液检验是否存在铁离子,进行判断硫酸亚铁是否变质;
II(1) 该药片能缓解胃酸过多,胃酸的主要成分是盐酸,能与盐酸反应的物质为有效成分;
(2)氢氧化铝是两性氢氧化物,即可与强酸反应又可与强碱反应,胃酸的主要成分是盐酸;
(3)氢氧化铝是两性氢氧化物,既可以酸式电离也可以碱式电离。
I (1)亚铁离子在溶液中呈浅绿色,硫酸亚铁片溶于水后产生亚铁离子,溶液的颜色是浅绿色;
(2) 硫酸根离子的检验:向溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生,方程式为SO42+Ba2+=BaSO4↓;
(3) 亚铁离子在水溶液中易水解,加盐酸增大氢离子浓度可以抑制水解;
(4) 硫酸亚铁若是变质,亚铁离子会被氧化成铁离子,所以可使用KSCN溶液检验,加入硫氰化钾,若溶液变成红色,证明硫酸亚铁已经变质,若溶液没有变成红色,证明硫酸亚铁没有变质;
II(1)该药片能缓解胃酸过多,胃酸的主要成分是盐酸,MgCO3、Al(OH)3与盐酸反应是有效成分;
(2)氢氧化铝是两性氢氧化物,即可与强酸反应又可与强碱反应,胃酸的主要成分是盐酸,可与氢氧化铝反应,利用了氢氧化铝的碱性,答案选B;
(3)氢氧化铝是两性氢氧化物,既可以酸式电离也可以碱式电离,电离方程式为:![]()
![]()
![]() 。
。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。
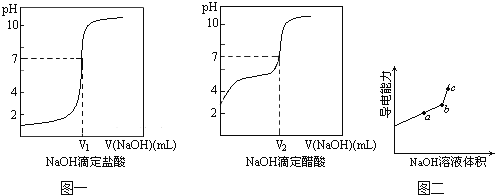
(1)某学习小组利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
③由计算机绘制的滴定曲线如图一:
两曲线图起点不同的原因是_____;两曲线图中V1_____V2 (填“>”、“=”或“<”)。
(2)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用_____(填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统.如果锥形瓶中含有少蒸馏水,是否会影响测量结果_____(填“是”、“否”、“不能确定”)。向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二)。
②醋酸与NaOH溶液反应的离子方程式为___________________________。
③图中b点时,溶液中各离子浓度大小的关系是_____________________。
④若图中某一点pH等于8,则c(Na+)﹣c(CH3COO﹣)的精确值为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
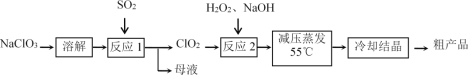
(1)“反应1”中的氧化剂是_____(填化学式,下同),母液中溶质的主要成分是_____。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3)如果将SO2换为Na2SO3和稀H2SO4,则“反应1”的离子方程式为________。
(4)“反应2”使用H2O2而不使用其他物质的主要理由是____________________。
Ⅱ.亚氯酸钠的应用
(5)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(6)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。
①上述反应的离子方程式为____________。
②ClO2也可用于杀菌消毒,其消毒能力是等物质的量Cl2的_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
A.Fe2O32SO37H2OB.4Fe2O310SO325H2O
C.3Fe2O36SO320H2OD.2Fe2O35SO317H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.FeCl2溶液中通入Cl2:![]()
B.Ba(OH)2溶液与盐酸的反应:![]()
C.Al(OH)3沉淀中滴加盐酸:![]()
D.AlCl3溶液中加入过量氨水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:![]() __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应![]() ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
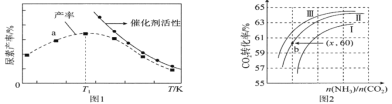
①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的![]() ,
,![]() ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
![]() ;
;
![]()
①25℃时,向N2H4水溶液中加入H2SO4,欲使![]() ,同时
,同时![]() ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )
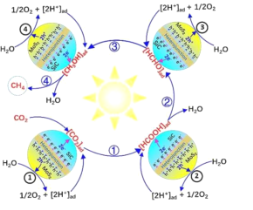
A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g)
CH4(g)+2O2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是
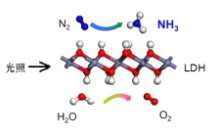
A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
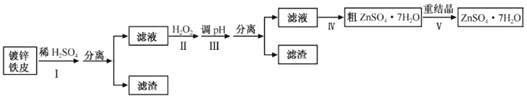
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
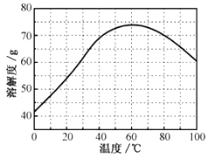
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是__。
②步骤Ⅰ可用于判断镀锌层完全反应的实验现象是__。
(2)步骤Ⅱ须加入过量H2O2理由是__。
(3)步骤Ⅲ,合适的pH范围是__。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序__。(操作可重复使用)
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO47H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择__方式进行冷却结晶。
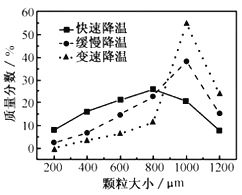
A.快速降温 B.缓慢降温 C.变速降温
(6)①ZnSO47H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是__。
A.图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图中滴定终点是的读数是___mL。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com