
300��Cʱ����2 mol A��2 mol B������������2 L�ܱ������У��������·�Ӧ��3A(g)��B(g) 2C(g)��2D(g)����H��Q,2 minĩ�ﵽƽ�⣬����0.8 mol D��
2C(g)��2D(g)����H��Q,2 minĩ�ﵽƽ�⣬����0.8 mol D��
(1)300��Cʱ���÷�Ӧ��ƽ�ⳣ������ʽΪK��________����֪K300��C<K350��C������H________0(����>������<��)��
(2)��2 minĩʱ��B��ƽ��Ũ��Ϊ_______��D��ƽ����Ӧ����Ϊ_______��
(3)���¶Ȳ��䣬��С�����ݻ�����A��ת����________(��������������С������������)��ԭ����__________________________________________��
(4)�������ͬ�������£�������Ӧ���淴Ӧ������У���ʼʱ������C��D��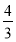 mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B________mol��
mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B________mol��
(1) 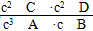 ��>
��>
(2)0.8 mol��L��1��0.2 mol��L��1��min��1
(3)���䡡��Ӧǰ������������ʵ������䣬ѹǿ��ƽ����Ӱ��
(4)4/3
��������(1)���¶�Խ�ߣ�KԽ����˵�����£�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����H>0��(2)����0.8 mol D����Ӧ��0.4 mol B��ʣ��1.6 mol B��c(B)��1.6 mol��2 L��0.8 mol��L��1��v(B)�� 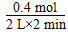 ��0.1 mol��L��1��min��1���ɻ�ѧ������֪��D�ķ�Ӧ����ӦΪB��2������v(D)��2v(B)��2��0.1 mol��L��1��min��1��0.2 mol��L��1��min��1��(3)�÷�ӦΪ��Ӧǰ������������ʵ�������ķ�Ӧ����ѹƽ�ⲻ�ƶ�����A��ת���ʲ��䡣(4)��C��D�����A��B�����൱�ڼ���2 mol A��2/3 mol B����������̶�����Ũ����ͬ����˵����ʼʱ���ʵ�����ȣ���B��Ӧ����2 mol��
��0.1 mol��L��1��min��1���ɻ�ѧ������֪��D�ķ�Ӧ����ӦΪB��2������v(D)��2v(B)��2��0.1 mol��L��1��min��1��0.2 mol��L��1��min��1��(3)�÷�ӦΪ��Ӧǰ������������ʵ�������ķ�Ӧ����ѹƽ�ⲻ�ƶ�����A��ת���ʲ��䡣(4)��C��D�����A��B�����൱�ڼ���2 mol A��2/3 mol B����������̶�����Ũ����ͬ����˵����ʼʱ���ʵ�����ȣ���B��Ӧ����2 mol��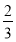 mol��
mol��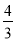 mol��
mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 8-4 ���ܵ���ʵ��ܽ�ƽ����ϰ���������棩 ���ͣ�ѡ����
��֪CuSO4��Һ�ֱ���Na2CO3��Һ��Na2S��Һ�ķ�Ӧ������£�
(1)CuSO4��Na2CO3
��Ҫ��Cu2����CO32����H2O=Cu(OH)2����CO2��
��Ҫ��Cu2����CO32��=CuCO3��
(2)CuSO4��Na2S
��Ҫ��Cu2����S2��=CuS��
��Ҫ��Cu2����S2����2H2O=Cu(OH)2����H2S��
���м������ʵ��ܽ�ȴ�С�ıȽ��У���ȷ����(����)
A��CuS<Cu(OH)2<CuCO3 ����B��CuS>Cu(OH)2>CuCO3
C��Cu(OH)2>CuCO3>CuS ����D��Cu(OH)2<CuCO3<CuS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 8-1 ������ʵĵ���ƽ����ϰ���������棩 ���ͣ�ѡ����
�й�ˮ�ĵ���ƽ���˵����ȷ����(����)
A��ˮ�����ӻ�ͨ����KW����ʾ�����¶ȱ仯���仯��ֻ�����ڴ�ˮ����ϡ��������ֵ����
B���ڴ�ˮ�м������������ˮ�ĵ��룬�Ӵ����ٽ�ˮ�ĵ���
C��������ˮ��ˮ�ĵ���ƽ���û��Ӱ��
D���ڴ�ˮ�м����������������ˮ�ĵ���ƽ���������Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 7-3 ��ѧƽ����ƶ���ϰ���������棩 ���ͣ�ѡ����
T��Cʱ����2 L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��
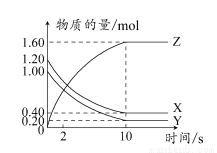
����������ȷ����(����)
A��ƽ��ʱ��X��Y��ת������ͬ
B���ﵽƽ����������ѹ��Ϊ1 L��ƽ��������Ӧ�����ƶ�
C��T��Cʱ���÷�Ӧ�Ļ�ѧ����ʽΪ��X(g)��Y(g) 2Z(g)��ƽ�ⳣ��K��40
2Z(g)��ƽ�ⳣ��K��40
D��T��Cʱ������ʼʱXΪ0.71 mol��YΪ1.00 mol����ƽ��ʱY��ת����ԼΪ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 7-3 ��ѧƽ����ƶ���ϰ���������棩 ���ͣ�ѡ����
���й��ڴ�����˵������ȷ����(����)
A���¶�Խ�ߣ������Ĵ�Ч��Խ��
B�������������ϵ�����ת�������ܼ����к������ŷ�
C���������Ըı仯ѧ��Ӧ���ʣ�����Ӧǰ�������ͻ�ѧ���ʲ���
D��п�����ᷴӦʱ�����뼸������ͭ��Һ�ɼӿ췴Ӧ���ʣ�������ͭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 7-2 ��ѧ��Ӧ�ķ��������ϰ���������棩 ���ͣ�ѡ����
E�Ƿǽ�������ǿ��Ԫ�أ�M��E����̬�⻯��ڹ̶�������ܱ������У�����M�������¹�ϵ��xM(g) Mx(g)����Ӧ�������������ʵ�����ʱ��ı仯��ϵ��ͼ������˵����ȷ����(����)
Mx(g)����Ӧ�������������ʵ�����ʱ��ı仯��ϵ��ͼ������˵����ȷ����(����)
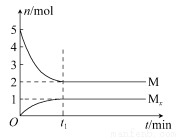
A���÷�Ӧ�Ļ�ѧ����ʽ��2HF (HF)2
(HF)2
B��ƽ��ʱ��������ƽ��Ħ��������33.3
C��t1ʱ�̣������¶Ȳ��䣬�ٳ���1 mol M�����´ﵽƽ��ʱ�� ������
������
D��M�ķе��ͬ������һ����Ԫ�ص���̬�⻯��е��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 7-2 ��ѧ��Ӧ�ķ��������ϰ���������棩 ���ͣ�ѡ����
��ͼ��ʾij���淴Ӧ��ʹ�ú�δʹ�ô���ʱ����Ӧ���̺������Ķ�Ӧ��ϵ������˵��һ����ȷ����(����)
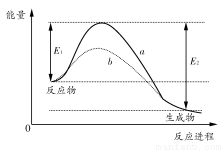
A��a��b��ȣ�b�Ļ�ܸ���
B����Ӧ��ϼ����յ�������С��������ɼ��ͷŵ�������
C��a��b��ȣ���Ӧ��ƽ�ⳣ��һ����ͬ
D��a��b��ȣ�a��Ӧ�ķ�Ӧ���ʸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 7-1 ��ѧ��Ӧ������ϰ���������棩 ���ͣ�ѡ����
���й��ڴ�����˵������ȷ����(����)
A���¶�Խ�ߣ������Ĵ�Ч��Խ��
B�������������ϵ�����ת�������ܼ����к������ŷ�
C���������Ըı仯ѧ��Ӧ���ʣ�����Ӧǰ�������ͻ�ѧ���ʲ���
D��п�����ᷴӦʱ�����뼸������ͭ��Һ�ɼӿ췴Ӧ���ʣ�������ͭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰��ܸ�ϰ 6-1 ��ѧ��Ӧ�е���ЧӦ��ϰ���������棩 ���ͣ�ѡ����
����˵����ȷ����(����)
A���κ��������кͷ�Ӧ����1 mol H2O�Ĺ����У������仯����ͬ
B��ͬ��ͬѹ�£�H2(g)��Cl2(g)=2HCl(g)�ڹ��պ͵�ȼ�����µ���H��ͬ
C����֪����2H2(g)��O2(g)=2H2O(g)����H����a kJ��mol��1����2H2(g)��O2(g)=2H2O(l)����H����b kJ��mol��1����a>b
D����֪����C(s��ʯī)��O2(g)=CO2(g)����H����393.5 kJ��mol��1����C(s�����ʯ)��O2(g)=CO2(g)����H����395.0 kJ��mol��1����C(s��ʯī)=C(s�����ʯ)����H����1.5 kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com