
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
分析 A.碳酸根离子与氢离子反应;
B.铁离子与碘离子、硫氰根离子反应;
C.四种离子之间不发生反应,能够共存;
D.铵根离子与氢氧根离子反应.
解答 解:A.H+、CO32-之间发生反应,在原子不能大量共存,故A错误;
B.Fe3+与I-、SCN-反应,在溶液中不能大量共存,故B错误;
C.Al3-、Cu2+、SO42-、NO3-之间不发生反应,在溶液中能够大量共存,故C正确;
D.NH4+、OH-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 从海水中获得精制食盐 | 用液氨制冷 | 用高粱、小麦酿酒 | 用铝制容器蒸、煮腌制的咸菜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的质量不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 单位时间内生成2a mol B,同时生成a mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
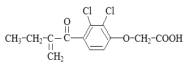 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
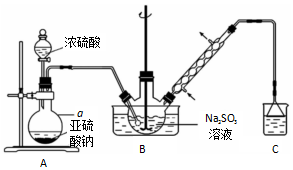
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com