
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
分析 (1)①物质的熔点与晶体类型有关,原子晶体熔点大于分子晶体熔点;原子晶体中,晶体熔点与其键长成反比;
②硅晶体中,每个硅原子连接4个硅原子;
③化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差;
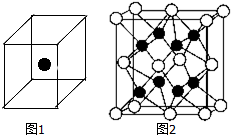
(2)在晶胞结构图中,空心球数目为$8×\frac{1}{8}+6×\frac{1}{2}$=4,实心球数目为8,结合化合物Na2O可知图中实心球表示化合物Na+,空心球表示O2-,以顶点空心球为例,周围距离最近的实心球有8个;
Na2O与MgO都是离子晶体,根据离子半径与晶格能的关系可判断熔点高低;
③根据$ρ=\frac{m}{V}$计算晶体的密度.
解答 解:(1)①碳化硅和硅都属于原子晶体,硅硅键键长大于碳硅键,晶体类型的物质中,物质的熔点与键长成反比,所以碳化硅的熔点大于硅;
原子晶体熔点大于分子晶体,四氯化硅属于分子晶体,二氧化硅属于原子晶体,所以四氯化硅熔点小于二氧化硅,
故答案为:>;<;
②硅晶体中,每个硅原子连接4个硅原子,且连接的4个硅原子形成正四面体结构,所以该硅原子相邻的硅原子表示为: ,
,
故答案为: ;
;
③该反应中的焓变=4×360kJ•mol-1+2×436kJ•mol-1-2×176kJ•mol-1-4×431kJ•mol-1=+236kJ•mol-1,故答案为:+236.
(2)在晶胞结构图中,空心球数目为$8×\frac{1}{8}+6×\frac{1}{2}$=4,实心球数目为8,结合化合物Na2O可知图中实心球表示化合物Na+,空心球表示O2-,以顶点空心球为例,周围距离最近的实心球有8个,所以O2-离子的配位数为8;
Na2O与MgO都是离子晶体,钠离子半径大于镁离子,所以氧化镁的晶格能大于氧化钠,所以MgO根据的熔点高于Na2O,
故答案为:8;MgO;
③根据(1)中的计算可知,每个晶胞中含有4个氧离子和8个钠离子,所以晶体的密度$ρ=\frac{m}{V}$=$\frac{\frac{4×(46+16)}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$g•cm-3=$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3,
故答案为:$\frac{248}{a{N}_{A}×1{0}^{-30}}$.
点评 本题涉及焓变的计算、物质熔点大小的判断、晶胞的结构、晶体的性质和晶胞密度计算等知识点,根据化学键计算反应方程式中的焓变、根据晶体类型及键长判断熔点高低,易错点是题中硅的化学键的计算方法,利用均摊法知每个硅原子含有两个硅硅键,为易错点,答题时注意利用均摊法计算出晶胞中所含微粒数.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )
已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )| A. | ZXY3 | B. | ZX2Y6 | C. | ZX4Y8 | D. | ZX8Y12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应可以进行 | D. | 2C-+B2═2B-+C2反应不能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com