
【题目】将2.3 g钠放入100 g水中,生成溶液中溶质的质量分数是
A. 等于2.3% B. 等于4% C. 大于2.3% D. 大于4%
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )min,原因是 .
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 . (设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列以减慢反应速率.(填写代号)
A.蒸馏水
B.冰块
C.HNO3溶液
D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图. 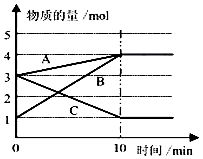
①该反应的化学方程式是 .
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率= ![]() ×100%】,请写出计算过程,计算结果保留1位小数)
×100%】,请写出计算过程,计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( ) 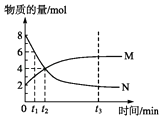
A.化学方程式:2NM
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,M的浓度是N浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为______________________________;为提高BaCO3的酸浸率,可采取的措施为___________________(任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是________________________。
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________________;
可循环使用的物质X是______。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、____和_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝均可在冷的浓硫酸或浓_____酸中发生钝化,即在表面生成一层致密的______;“铁红”的主要化学成分是_____;Fe2(SO4)3溶液呈_____色;生铁主要是铁和__的合金。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 12.0gNaHSO4固体中含阳离子数为0.1NA
B. 50mL18mol·L-1 浓硫酸与足量铜微热反应,转移的电子数为1.8NA
C. 标准状况下,22.4L苯中所含分子数为NA
D. 7.8gNa2O2与足量的水反应转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关铝及其化合物的说法错误的是
A. 用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B. 铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜
C. 氧化铝是一种难熔物质,是一种较好的耐火材料
D. 氧化铝能中和胃酸,可用于制胃药
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com