
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含有极性键的分子一定不含非极性键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
分析 A.含离子键的一定为离子化合物;
B.多原子构成的分子中一定存在化学键;
C.含有极性键的分子,可能含非极性键;
D.含有共价键的化合物可能为离子化合物.
解答 解:A.含离子键的一定为离子化合物,离子化合物中一定含有离子键,故A正确;
B.多原子构成的分子中一定存在化学键,如氢气等,而单原子构成的分子不含化学键,如稀有气体,故B错误;
C.含有极性键的分子,可能含非极性键,如H-O-O-H中含极性键和非极性键,为极性分子,故C错误;
D.含有共价键的化合物可能为离子化合物,如NaOH中含共价键和离子键,故D错误;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及举例法解答此类习题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
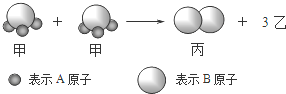
| A. | 1个乙分子中含有2个A原子 | B. | 摩尔质量关系为:2M (甲)=M (乙)+M (丙) | ||
| C. | 该反应一定属于氧化还原反应 | D. | 该反应类型是分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 氯化铵的分解和氯化钠溶解于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
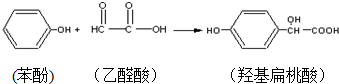
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA | |
| C. | 乙醛酸的核磁共振氢谱图只有一组峰 | |
| D. | 羟基扁桃酸分子中至少有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
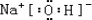 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
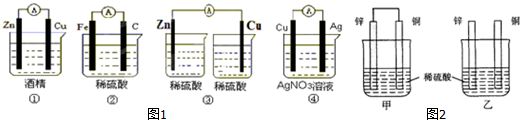
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com