
下列各组离子或分子能大量共存,当加人相应试剂后,发生反应的离子方程式书写正确的是( )
选项 | 离子组 | 加人试剂 | 加人试剂后发生反应的离子方程式 |
A. | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++ SO42- + 2OH- = BaSO4↓+ 2NH3 • H2O |
B. | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
C. | K+、NH3·H2O、CO32- | 通人少量CO2 | 2OH-+CO2=CO32-+H2O |
D. | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3- +H+ = SO2↑+H2O |
科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:选择题
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是
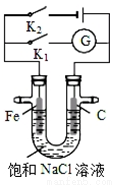
A.K1闭合,铁棒上发生的反应为2H+ + 2e﹣= H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三11月阶段测化学卷(解析版) 题型:填空题
某条件下,在2 L密闭容器中发生如下反应:2NO2 (g) 2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
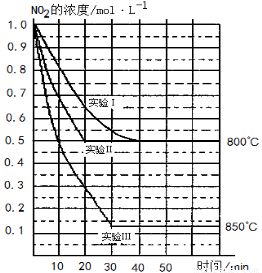
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡时NO2浓度减少了0.5mol/L,则根据方程式可知生成氧气是0.25mol/L,因此用氧气浓度变化表示的化学反应速率为0.25mol/L÷20min= 。
(3)800℃时,该反应的平衡常数K= 。该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体 (保持温度不变),此时平衡将向 移动 (填“正反应方向”或“逆反应方向”),你判断的依据是 。
(5)NO2、NO是重要的大 气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2
气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:选择题
下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.属于酯类的有4种 B.属于羧酸类的有2种
C.既含有羟基又含有醛基的有3种 D.存在分子中含有六元环的同分异构体
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:填空题
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g)  CH3OH(l) + H2O(l)。
CH3OH(l) + H2O(l)。
(1)①该反应自发进行的条件是___________(填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是___________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H—H键断裂
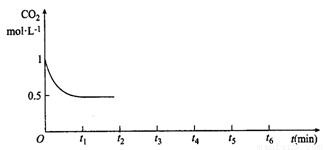
③CO2的浓度随时间(0~t2)的变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6的浓度随时间的变化。
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K( I ) __________K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)___ ________c(II)。
②对反应I,前10 min内的平均反应速率v(CH3OH) =____________,在其他条件不变下,若30 min时只改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_________T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡 ______________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:填空题
向浓度相等、体积均为50 mL 的 A、B 两份NaOH 溶液中,分别通入一定量的CO2后,再稀释到100 mL。
(1)在 NaOH 溶液中通入一定量的 CO2 后,溶液中溶质的可能组成是
①_________, ②________, ③________, ④________。
(2)在稀释后的溶液中逐滴加入0.2 mol/L 的盐酸,产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。
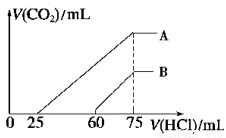
①A 曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生 CO2 的最大体积是_____mL(标准状况)。
②B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
③原 NaOH 溶液的物质的量浓度为________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:选择题
下列物质在光照时不反应的是( )
A. 氢气和氯气的混合气体 B. 硝酸 C. 氢气和氧气的混合气体 D. 氯水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
室温下向10 mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
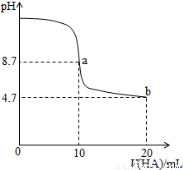
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A-)+c(HA)
D.b点所示溶液中c(A-)> c(HA)
答
查看答案和解析>>
科目:高中化学 来源:2017届西藏拉萨中学高三上期末理综化学卷(解析版) 题型:选择题
下列有关氨或铵盐的说法不正确的是
A.可用湿润的红色石蕊试纸检验氨气
B.用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl-)
C.NH3属于弱电 解质
解质
D.常温时,0.1mol·L-1NH4Cl溶液加水稀释, 的值不变
的值不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com