
分析 化合物和水中的H+、OH-(或-H、-OH)交换成分生成两种或两种以上物质的反应称为水解反应.水解反应肯定为非氧化还原反应.常见的有盐类的水解、卤代烃的水解、酯类的水解、二糖及多糖的水解、二肽或多肽的水解等,据此进行判断.
解答 解:①淀粉发生水解反应生成葡萄糖,该反应属于水解反应,故①正确;
②乙烯与水发生加成反应生成乙醇,不属于水解反应,故②错误;
③铝离子发生水解反应生成氢氧化铝和氢离子,属于水解反应,故③正确;
④一水合氨为弱电解质,电离生成铵根离子和氢氧根离子,该反应不属于水解反应,故④错误;
⑤乙醇钠发生水解生成乙醇和氢氧化钠,该反应属于水解反应,故⑤正确;
⑥硫化镁发生水解反应生成氢氧化镁和硫化氢,属于水解反应,故⑥正确;
故选①③⑤⑥.
点评 本题考查了有机物结构与性质、常见有机反应的类型及判断,题目难度中等,注意明确有机物结构与性质,掌握常见的有机反应类型、概念及判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 硫酸铜溶液 | C. | 氢氧化钠溶液 | D. | 水溶解度/gA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3.H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| C. | Cu与浓硝酸反应制备N02:3Cu+8H++2NO${\;}_{3}^{-}$═3Cu2++2NO2↑+4H2O | |
| D. | 向KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═AlO${\;}_{2}^{-}$+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

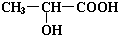 +2Na→
+2Na→ +H2↑
+H2↑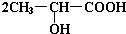 +Na2CO3→
+Na2CO3→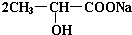 +H2O+CO2↑,
+H2O+CO2↑,
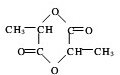
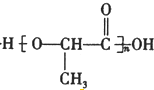
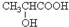 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含Ba2+的数目为0.1NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 7.1g氯气与足量热烧碱溶液反应,转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:
A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2价 | B. | +3价 | C. | +4价 | D. | +6价 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com