
| A. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe2++2Br2+6Cl- | |
| B. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| C. | 酚酞滴入碳酸钠溶液中,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | 将铝条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ |
分析 A.亚铁离子的还原性大于溴离子,亚铁离子优先反应,剩余的氯气再与溴离子反应;
B.当二者的物质的量相等时生成亚硫酸氢钠,当n(NaOH):n(SO2)=4:3时生成亚硫酸钠和亚硫酸氢钠的混合物;
C.碳酸钠溶液中,碳酸根离子部分水解,溶液呈碱性,由于水解程度较小,离子方程式应该用可逆号;
D.2mol铝与氢氧化钠溶液反应生成3mol氢气,该反应不满足电子守恒.
解答 解:A.Cl2与FeBr2溶液反应,亚铁离子的还原性较强,当n(Cl2):n(FeBr2)=1:1时,氯气不足,亚铁离子优先反应,正确的离子方程式为:2Fe2++2Br-+2Cl2═2Fe2++Br2+4Cl-,故A错误;
B.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,二者反应生成亚硫酸钠和亚硫酸氢钠,反应的离子方程式为:4OH-+3SO2═SO32-+2HSO3-+H2O,故B正确;
C.酚酞滴入碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性,则溶液变红,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故C错误;
D.将铝条投入NaOH溶液中,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 | |
| B. | 准确量取24.00 mL的液体可选用滴定管、量筒或滴定管 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,增大压强,平衡会正向移动,$\frac{{c}^{2}({SO}_{3})}{{c}^{2}({SO}_{2})•c{(O}_{2})}$ 的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
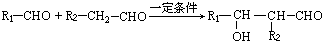
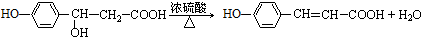
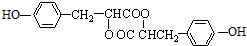 .
.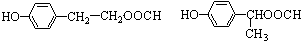 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
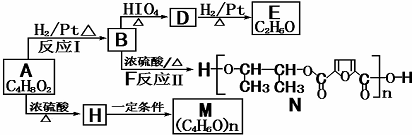
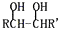 $→_{△}^{HIO_{4}}$RCHO+OHCR′
$→_{△}^{HIO_{4}}$RCHO+OHCR′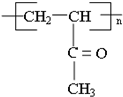
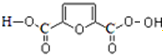 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
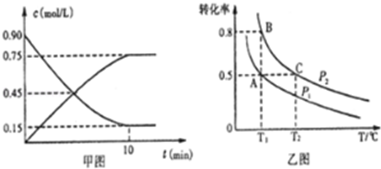
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
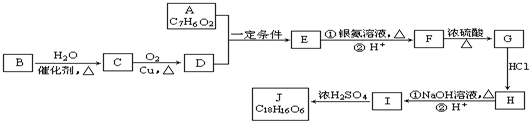
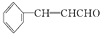 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: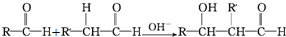
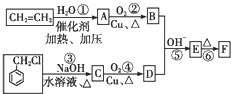
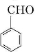 ;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.
;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.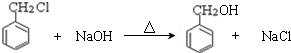 .
.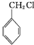 )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).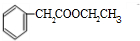
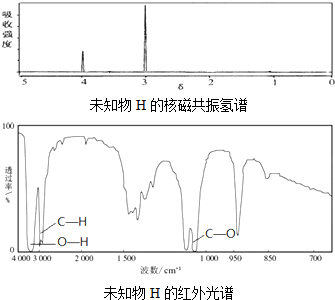
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Pt(Ⅱ)为阳极 | B. | 阳极区酸性增强 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 NaOH 溶液中通入过量 C02:20H-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2C1-+2H20$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+20H- | |
| C. | 向 H202 溶液中加入 Mn02:2H202+4H++Mn02=02↑+Mn2++4H20 | |
| D. | 向KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++40H-=A1O2-+2BaS04+2H20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com