
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)①HSO3-电离程度大于水解程度,据此判断溶液酸碱性;
②当n(SO32-):n(HSO3-)=1:1时溶液的pH=7.2,呈碱性,当溶液呈中性时,溶液中c(H+)=c(OH-),n(SO32-)=n(HSO3-)<1:1,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
(2)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡.
解答 解:(1)①在亚硫酸氢钠溶液中,HSO3-存在:HSO3-?H++SO32-和 HSO3-+H2OH2SO3+OH-;HSO3-的电离程度强于水解程度,所以溶液中c(H+)>c(OH-),则溶液呈酸性,
故答案为:酸;HSO3-存在:HSO3-?H++SO32-和 HSO3-+H2OH2SO3+OH-,HSO3-的电离程度强于水解程度;
②当n(SO32-):n(HSO3-)=1:1时溶液的pH=7.2,呈碱性,当溶液呈中性时,溶液中c(H+)=c(OH-),n(SO32-)=n(HSO3-)<1:1,溶液中存在电荷守恒和物料守恒,
A.根据电荷守恒得c(Na+)=2c(SO32-)+c(HSO3-),故正确;
B.溶液中c(HSO3-)>c(SO32-),根据电荷守恒c(Na+)=2c(SO32-)+c(HSO3-)得c(Na+)>c(HSO3-),所以离子浓度大小顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故正确;
C.根据电荷守恒得c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故错误;
故选ab;
(2)A.滴入酚酞试液变红,说明溶液呈碱性,再加入硫酸溶液后,硫酸与亚硫酸钠反应,且硫酸溶液呈酸性,可以时溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故A错误;
B.滴入酚酞试液变红,再加入氯水后,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使红色褪色,氯气具有强氧化性,Cl2+SO32-+H2O═SO42-+2Cl-+2H+,Cl2+HSO3-+H2O═SO4 2-+2Cl-+3H+,溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故B错误;
C.滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在SO32-+H2O?HSO3-+OH-水解平衡,故C正确,
故选C.
点评 本题考查离子浓度大小比较、盐的水解原理及其应用,题目难度不大,明确盐的水解原理及其影响为解答关键,试题侧重基础知识的考查,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑧ | B. | ③⑤⑧ | C. | ②④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:3 | C. | 3:2 | D. | 7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②④⑥ | C. | ①⑥⑦ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Z2+2A2+═2A3++2Z-能够进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 反应①的离子方程式为:16H++10Z-+2XO4-═2X2++5Z2+8H2O | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铁的质量为5.4 g | |
| B. | 合金与稀硫酸反应共生成0.45 mol H2 | |
| C. | 该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA | |
| D. | 所加的稀硫酸中含0.6 mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
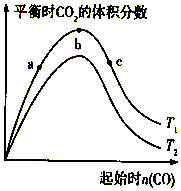 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 1mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com