
已知Q和R的摩尔质量之比是9:22,在反应X+2Y=2Q+R中,当1.6gX与Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为
A.46:9
B.32:9
C.23:9
D.16:9
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. c(I-)=0.1mol.L-1的溶液中:K+、Na+、SO42-、ClO-
B.使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C.与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+
D.由水电离出的c(OH-)=1×10--10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期期中化学试卷(解析版) 题型:选择题
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法正确的是
A.MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al
B.水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C.医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙;
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省琼海市高一上学期第一次月考化学试卷 题型:选择题
下列叙述不正确的是
A.CO2的摩尔质量是44g·mol-1,表示1molCO2的质量为44g
B.硫酸溶液的物质的量浓度为1mol·L-1,表示1L溶液中含有1mol硫酸
C.气体摩尔体积Vm≈22.4L·mol-1,表示1mol任何气体的体积都约为22.4L
D.阿伏加德罗常数NA≈6.02×1023mol-1,表示1mol任何粒子集体所含的该粒子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省遵义市高一上学期期中考试化学试卷 题型:实验题
(1)请写出该实验的实验步骤①溶解②冷却③转移④_______⑤______⑥摇匀
(2)现在已有下列仪器:托盘天平,烧杯,量筒,要完成本实验还需仪器为:_________________、___________________。
(3)试分析下列操作对所配溶液的浓度有何影响(偏高、偏低或者无影响)及造成该影响的原因。
①容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度的影响,原因是:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响,原因是:。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省遵义市高一上学期期中考试化学试卷 题型:选择题
过滤后的食盐水中仍然含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序为
A.③②①⑤④
B.①②③⑤④
C.②③①④⑤
D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省遵义市高一上学期期中考试化学试卷 题型:选择题
下列离子方程式书写正确的是
A.实验室制备CO2的反应为:CaCO3+2HCl=CaCl2+H2O+CO2↑
B.向氯化铜溶液中滴加硝酸银溶液:Ag++Cl-=AgCl↓
C.氢氧化钡和稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.稀硫酸滴到铜片上:Cu+2H+=Cu2++H2?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试化学(文)试卷 题型:选择题
下列关于食品添加剂的叙述中不正确的是
A.醋可同时用作防腐剂和调味剂
B.亚硝酸钠可以用作防腐剂,但不宜过量[来源:学科网
C.我国应禁止使用味精
D.苯钾酸钠可用作食品的防腐剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试(理科)化学试卷 题型:填空题
(1)氢气的燃烧热是285.8KJ/mol,则表示氢气燃烧热的热化学方程式为 ;
(2)1.6g液态化合物N2H4与液态H2O2恰好完全反应生成两种对环境友好的气体,此时放出75KJ的热量,请写出该反应的热化学方程式 ;
(3)已知Ba2++SO42-=BaSO4(s)△H=-aKJ/mol(视a为已知数),请写出稀硫酸与稀Ba(OH)2溶液反应的热化学方程式 ;
(4)已知2NH3(g) N2(g)+3H2(g)△H=+92.4KJ/mol,把1molN2(g)和3molH2充入密闭容器中充分反应,测得放出的热量始终小于92.4KJ。请简述其原因 ;
N2(g)+3H2(g)△H=+92.4KJ/mol,把1molN2(g)和3molH2充入密闭容器中充分反应,测得放出的热量始终小于92.4KJ。请简述其原因 ;
(5)请仔细看图,
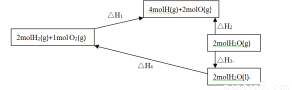
根据盖斯定律,△H4=(用△H1、△H2、△H3表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com