
科目:高中化学 来源:2015-2016学年江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+)/c(NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2016届西藏自治区拉萨中学高三上学期第四次月考化学试卷(解析版) 题型:填空题
为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
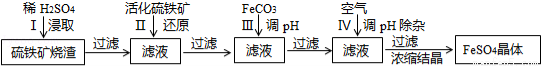
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号)。
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:填空题
水是最常用的溶剂,许多化学反应都需要在水溶液中进行。请仔细分析并回答下列各题。
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
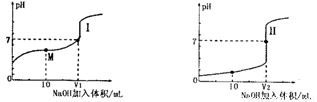
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为________,符合其滴定曲线的是_______(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是_________溶液(填化学式);
③图中v1和v2大小的比较:v1_______v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是______________。
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25 ℃ ):
操作步骤 | 现象 |
步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
① 请结合化学用语和必要的文字解释步骤2 现象出现的原因:____________________。
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为______________(任写一点即可)。
③ 写出步骤4 中沉淀转化反应平衡常数的表达式:K=__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:填空题
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+ = Mn2++ Fe3++ H2O。下列说法正确的是
A.MnO4-是氧化剂,Fe3+是还原产物
B.Mn2+的还原性强于Fe2+
C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4
D.生成1 mol 水时,转移2.5 mol电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
下列变化过程中,需要加入还原剂的是
A.MnO2→MnO4- B.Al(OH)4-→Al(OH)3 C.SO32-→SO42- D.MnO2→MnCl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:填空题
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
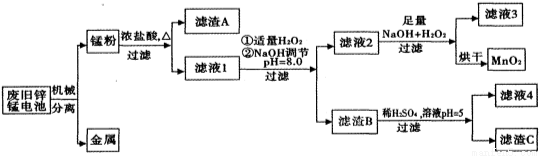
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是____________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期末理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的熵增
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上第一阶段测化学试卷(解析版) 题型:选择题
已知:2CH3OH(g) CH3OCH3(g)+H2O(g) △H= -25 kJ•mol-1。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表,下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) △H= -25 kJ•mol-1。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表,下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/(mol•L-1) | 0.08 | 1.6 | 1.6 |
A.此时刻反应达到平衡状态
B.容器内压强不变时,说明反应达平衡状态
C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D.平衡时,反应混合物的总能量降低40kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com