
����Ŀ������β���ﺬ��NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�N2(g) + O2(g) ![]() 2NO(g) ��H>0����֪�÷�Ӧ��ij�¶�ʱ��ƽ�ⳣ��K = 6.4��10-3���ش�:
2NO(g) ��H>0����֪�÷�Ӧ��ij�¶�ʱ��ƽ�ⳣ��K = 6.4��10-3���ش�:
(1)ij�¶��£���2 L���ܱ������г���N2��O2��1 mol��5���Ӻ�O2�����ʵ���Ϊ0.6 mol����N2�ķ�Ӧ����Ϊ_______________��
(2)�ٶ��÷�Ӧ���ں��¡���ѹ�����½��У��жϸ÷�Ӧ�ﵽƽ��ı�־_______������ĸ���)��
A����������ܶȲ���
B������1 mol N2ͬʱ����2 mol NO
C���������ƽ����Է�����������
D��2����(N2) = ����(NO)
(3)��N2��O2�Ļ�����������º����ܱ������У����б仯���Ʋ���ȷ����_______������ĸ���)��

(4)����º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ����������NO���������______(��������С�����䡱)��
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1 mo1/L��4.0��10-2 mo1/L��8.0��10-2 mo1/L����ʱ��Ӧ_____________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��������____________________��
���𰸡�0.04 mol/(L��min) BD B ���� ���淴Ӧ������� Qc>K
��������
���ݷ�Ӧ���ʵĶ��塢��ѧƽ���������ƽ���ƶ�ԭ���ȷ������
(1)��(N2)����(O2)��![]() ��
��![]() ��0.04 mol/(L��min)��
��0.04 mol/(L��min)��
(2)A�������������������ķ�Ӧ�����¡���ѹʱ��������䣬��Ӧ��ֻ�����壬�����������䣬��������ܶȱ�Ȼ���䣬������Ϊƽ���־��
B������Ӧ����1 mol N2�ض�����2 mol NO����֪ͬʱ����2 mol NO����NO���ʵ������ٱ仯������Ϊƽ���־��
C����Ӧ�л������������ʵ����������������䣬��Ħ��������ƽ����Է���������Ȼ���䣬������Ϊƽ���־��
D��ֻ�л�ѧƽ��ʱ����ͬ���ʱ�ʾ�������淴Ӧ����֮�Ȳŵ��ڻ�ѧ������֮�ȡ�����2����(N2) = ����(NO)������Ϊƽ���־��
��ѡBD��
(3)Aͼ��������Ӧ���ȵĿ��淴Ӧ�������¶�ƽ�����ƣ�ʹK���Aͼ��ȷ��
Bͼ�������ܼӿ컯ѧ��Ӧ����ʼʱ�д�����Ӧ�ȴﵽƽ�⣬����������ʹƽ���ƶ����С�����ƽ��ʱNOŨ��Ӧ��ͬ��Bͼ����
Cͼ��T1�¶Ƚϸߣ���Ӧ�ȴﵽƽ�⡣�����ȷ�Ӧ�������¶�ƽ�����ƣ�����ת��������Cͼ��ȷ��
��ѡB��
(4)����ѧ����ʽ��һ������NO�൱�ڵ����ʵ�����N2��O2��ɵĻ�����壬���NO����һ������������н�����ԭƽ���Ч�Ļ�ѧƽ�⡣����ԭ�ܱ��������º��ݣ���NO������ƽ�Ⲣ�루�൱�ڼ�ѹ���������������������ķ�Ӧƽ�ⲻ�ƶ�����NO�������������
(5)��ijʱ�̵�Ũ�����ݣ����ʱ�̵�Ũ����Qc��![]() ��
��![]() ��0.64����Qc>K���ʷ�Ӧ������С�
��0.64����Qc>K���ʷ�Ӧ������С�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������з������·�Ӧ��X(g)��3Y(g)![]() 2Z(g)����H��0����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ����
2Z(g)����H��0����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ����

A. t2ʱ�����˴��� B. t3ʱ�������¶�
C. t5ʱ������ѹǿ D. t4��t5ʱ����ת����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ������A������ɱ���ܱ������У�����B��������Ӧ��A(s)��2B(g)![]() 4C(g)��D(g)��H<0����һ���¶ȡ�ѹǿ�´ﵽƽ�⡣ƽ��ʱC�����ʵ���������B�����ʵ����ı仯��ϵ��ͼ������˵����ȷ����
4C(g)��D(g)��H<0����һ���¶ȡ�ѹǿ�´ﵽƽ�⡣ƽ��ʱC�����ʵ���������B�����ʵ����ı仯��ϵ��ͼ������˵����ȷ����

A. ���¶����ߺ���ͼ�Цȣ�45��
B. ���ټ���B���ٴδﵽƽ��״̬ʱ�������淴Ӧ���ʾ�����
C. ƽ��ʱB��ת����Ϊ50%
D. ���ټ���B����ƽ���Ӧ��ϵ�����ܶȼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=2��A��B��������Һ��1 mL���ֱ��ˮϡ�͵�1000 mL������pH����Һ���V�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )

A. A��B������Һ�����ʵ���Ũ��һ�����
B. ϡ�ͺ�A����Һ�����Ա�B����Һǿ
C. a=5ʱ��A��ǿ�ᣬB������
D. ��aС��5����A��B�������ᣬ��A����������B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѳ������еĵ��������Ҫ��ָNO��NO2�����Ծ������������ƻ������ǻ�����������Ҫ���⡣
��1����Ư�۾���ҺΪ���ռ��ѳ������е�NO������Ȼ�ѧ����ʽ���£�
����4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =��423 kJ��mol-1
����Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =��120 kJ��mol-1
����3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
�� H3 = _______kJ��mol-1 ��
�� ��Ӧ����ƽ�ⳣ�����¶����ߵı仯������________��
��2��HClO����Ч�ѳ�NO����HClO���ȶ���ʵ��Ӧ���г������Ρ�C12��Ca(OH)2��ȡƯ�۾��Ļ�ѧ����ʽ��________��
��3�����������ѳ�NO����Ҫ�������£�
a��NO+HClO = NO2+HCl
b��NO + NO2+H2O 2HNO2
c��HClO+ HNO2 = HNO3+HCl
���з�����ȷ����________��
A�������к��е�����O2�����NO���ѳ���
B��NO2��������ʱ���ܱ��ѳ�
C���ѳ������У�����������Һ��pH�½�
��4���о���ͬpH����ͬ�¶���Ư�۾���Һ��NO�ѳ��ʵ�Ӱ�죬�����ͼ1��ͼ2��
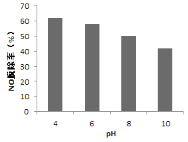

ͼ1 ͼ2
�� ͼ1�У�pH����NO�ѳ��������ԭ��________��
�� �ѳ�������������Cl2������ԭ����________�������ӷ���ʽ��ʾ����
�� ͼ2�У�60��80�� NO�ѳ����½���ԭ��________�������ٴ�����㣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���� �� ��
A. Ũ����ϡ��ʱ��Һ�¶����ߣ�˵��Ũ����ϡ��ʱֻ��ˮ�Ϲ���
B. �����Ƿǵ���ʣ�����ˮ����Һ�¶�û�����Ա仯��˵����������ˮ��û����ɢ������û��ˮ�Ϲ���
C. ����ʯ��(![]() )���ú��ɿ�״��ɷ�ĩ״����һ�仯�Ƿ绯�Ľ��
)���ú��ɿ�״��ɷ�ĩ״����һ�仯�Ƿ绯�Ľ��
D. �ӱ�����ȡ����Ʒ������ܿ����ˮ�飬��������г���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ![]() ��
��![]() װ�õ���Ȼ�ͭ��Һ�ͱ���ʳ��ˮ�������жϴ�����ǣ� ��
װ�õ���Ȼ�ͭ��Һ�ͱ���ʳ��ˮ�������жϴ�����ǣ� ��

A. ����ʧ���ӵ�������ͬ��������ͬ
B. ����������õ��ӵ����Ӳ�ͬ����ͬ
C. ������װ������Һ��pH����С
D. ����ֻ��![]() װ����������������
װ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(LiNH2)��һ�ְ�ɫ�й���Ľᾧ���ĩ���۵���390�棬�е���430�棬������ˮ������ˮ��ǿ��ˮ�⡣��380��400��ʱ��백��ֱ�ӷ�Ӧ���Ƶ�LiNH2��������ʵ�����Ʊ�LiNH2ʱ�����õ���װ��ͼ���ش��������⡣

(1)�����Լ����ʽǶȷ��������и����Լ���������ʵ�����Ʊ�NH3����___________(����ĸ)��
A��Ũ��ˮ��CaO B��NH4Cl���塢Ca(OH)2����
C��Ũ��ˮ D��NH4NO3���塢NaOH����
(2)��(1)�к��ʵ��Լ���ȡ��NH3�����������������ң���ͼ��װ�õ�����˳��Ϊ___________(��ӿڴ���ĸ)��װ��A��������______________________��
(3)װ��C��������������___________��ʢװ���Լ���___________��ʵ�鿪ʼ����X��ͨ��NH3���������X���Ⱥ�˳��Ϊ___________��
(4)ʵ���һ�����Ũ��ˮ�����NaOH����Ʊ������������ʵ��������˷����ռ�����NH3�����DZ�����ֵ�����࣬������ܵ�ԭ����______________________��
(5)�����������ˮ��Ӧ����LiOH��һ�����壬���Ʋ������ijɷֲ���ʵ����֤��Ľ��ۣ�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�˵����ȷ����
A.46g N2O4�����к��е�ԭ����Ϊ3NA
B.��״���£�22.4L SO3�к���SO3������ΪNA
C.50mL 12mol��L-1����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA
D.�õ�ⷨ����ͭ�ķ�Ӧ��ת��0.2NA������ʱ�������ܽ�6.4gͭ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com