
【题目】下列离子可大量共存且溶液无色的是( )
A. Cu2+、SO42-、Fe3+、Cl- B. Na+、NO3-、K+、SO42-
C. MnO4-、Al3+、Na+、SO42- D. Fe2+、H+、ClO-、CO32-
科目:高中化学 来源: 题型:
【题目】据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可成甘油、医药、农药香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含__________molσ键,烯丙醇分子中碳原子的杂化类型为_____________。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________,与SCN-互为等电子体的分子为____________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组提取三处被污染的水源进行了如下分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B________,D________。
(2)写出D、E发生反应的离子方程式:___________________________。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为__________。
(3)C常用作净水剂,用离子方程式表示其净水原理:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度和压强一定时,决定气体体积大小的主要因素是( )
A. 分子数目的多少 B. 分子间距离的大小
C. 分子间引力的大小 D. 分子直径的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA为一元酸,常温下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是
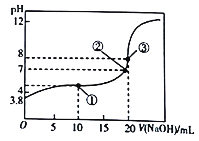
A. 常温下,该酸的电离常数K=10-5.6
B. 该测定过程中不可以选择甲基橙为指示剂
C. 滴定至①处时,溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mLB. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.硅元素广泛存在于自然界中,天然单质硅叫硅石
B.二氧化硅在信息高速传输中有重要应用
C.常温下硅很稳定,不与强酸发生反应
D.二氧化硅可用于制造玻璃、单质硅、光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的离子反应方程式正确的是
A. 少量的 SO2 通入 NaClO 溶液:SO2+H2O+2ClO-=SO32-+2HClO
B. 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C. 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl―+Cl2↑+2H2O
Mn2++2Cl―+Cl2↑+2H2O
D. 等浓度的 NaHSO4 与 Ba(OH)2 混合至溶液呈中性:Ba2++2OH―+SO42―+2H+=BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com